
【题目】某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)![]() C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
【题目】如图是钢铁电化学保护的示意图。分析正确的是

A. 若a、b两端用导线相连,Fe作正极
B. 若a、b两端用导线相连,Zn被还原
C. 若a、b两端与电源相连,Fe作阳极
D. 若a、b两端与电源相连,Zn极得电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列燃烧反应的反应热是燃烧热的是( )
A. H2(g)+![]() O2(g)===H2O(g)ΔH1 B. C(s)+O2(g)===CO(g)ΔH2
O2(g)===H2O(g)ΔH1 B. C(s)+O2(g)===CO(g)ΔH2
C. S(s)+O2(g)===SO2(g)ΔH3 D. H2S(g)+![]() O2(g)===S(s)+H2O(l)ΔH4
O2(g)===S(s)+H2O(l)ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】说明氨水是弱碱的事实是: ( )
A. 氨水具有挥发性。 B. 1mol/L氨水溶液1升可以与1molHCl完全反应
C. 1mol/L NH4Cl溶液的pH=5 D. 氨水与AlCl3溶液反应生成Al(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种十分熟悉的物质,在许多反应中既可作为反应物,也可作为生成物。
(1)电解饱和食盐水可制取氢气,反应的化学方程式____。
(2)在氢气还原氧化铜的反应中,标出电子转移的方向及数目。____
H2+CuO![]() Cu+H2O
Cu+H2O
(3)在铜锌原电池中,如图,在铜极附近看到的现象是____;电子流向从___。

(4)氢气作为燃料,有1g氢气燃烧生成液态水放出142.8kJ热量,表示该反应的热化学方程式_____。
(5)实验室用锌与稀硫酸反应制取氢气,某学校实验员为了提高制氢的速度,在此溶液中加入少量硫酸铜溶液,你认为合理吗?为什么?____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4molMnO2和100mL12mol/L盐酸混合后加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸挥发)
A.等于0.6molB.小于0.6molC.大于0.6molD.等于0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:
(1)基态Ga原子价层电子的轨道表达式为_________________________,第一电离能介于N和B之间的第二周期元素有_______种。
(2)HCN分子中σ键与π键的数目之比为_______,其中σ键的对称方式为___________。与CN—互为等电子体的分子为___________。
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为_________。NF3的空间构型为____________。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因_________________________________________________________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如下图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。


① 晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____________;
② GaN的密度为______________________g·cm3(用a、NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495 kJ·mol-1,其第二电离能增幅较大的原因是___________。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________。CrCl3·6NH3有三种异构体,分别是[Cr(NH)3)6]Cl3、___________、[Cr(NH)4Cl2] Cl·2NH3。
(5)NH4N3是在的高能量度材料,其品胞构如图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________。NH4+的 VSEPR模型名称为___________。

(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
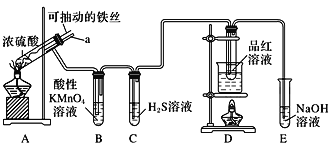
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com