
【题目】室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是
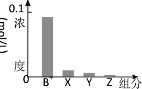
A.溶液显酸性
B.升温,c(X)增大,c(Y)减小
C.c(B+) + c(Y) = c(Cl-)
D.稀释溶液,c(X)增大,c(Z)增大
科目:高中化学 来源: 题型:
【题目】把35.7g金属锡投入300 mL 14 mol /L HNO3共热(还原产物为NOx),完全反应后测得溶液中c(H+) = 10 mol /L,溶液体积仍为300 mL。放出的气体经水充分吸收,干燥,可得气体8.96 L(S.T.P)。由此推断氧化产物可能是
A.Sn(NO3)4B.Sn(NO3)2C.SnO24H2OD.SnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和铜合金广泛用于电气、机械制造、建筑工业、国防工业等领域。
(1)以含Cu2S80%的精辉铜矿为原料冶炼金属铜(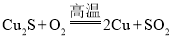 )。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
)。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
(2)高温时,Cu2S和O2在密闭容器中实际发生的反应为以下两步:
2Cu2S+3O2![]() 2Cu2O+ 2SO2、2Cu2O+ Cu2S
2Cu2O+ 2SO2、2Cu2O+ Cu2S![]() 6Cu+ SO2↑
6Cu+ SO2↑
取amol Cu2S和bmol空气(设氧气占空气体积的20%)在高温下充分反应。根据下列几种情况回答问题(反应前后温度、容器体积不变):
①若反应后剩余固体只有Cu,则a和b的关系是___________。
②若反应后剩余固体是Cu2S和Cu,则反应前容器内压强(P1)与反应后容器内压强(P2)的关系是_______。
③若反应后容器内的压强小于反应前,通过分析,确定反应前后容器内固体的成分___________。
(3)可用纯度为80%的精辉铜矿制备胆矾。称取8.0g矿样,溶解在40mL14.0mol/L的浓硝酸中(杂质不反应),反应为: 2Cu2S+14H++10NO3-→4Cu2++2SO42-+5NO↑+5NO2↑+7H2O。过滤后向所得溶液再加入适量的铜和稀硫酸,充分反应前后,将该溶液蒸发结晶。计算理论上最多可得到CuSO4·5H2O晶体多少克_______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数。下列叙述正确的是
A.1.2g金刚石中含有的碳碳单键数为0.4NA
B.300 mL 2 mol/L乙醇水溶液中所含H原子数为3.6NA
C.2.3 g钠在O2中充分反应得到3.5 g固体,转移电子数为0.15NA
D.标准状况下,22.4 L丙烯中含有碳氢键数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝有多种化合物,在工业上用途广泛。氮化铝(AlN)中混有碳和氧化铝,为确定某氮化铝样品的纯度,进行如下实验:(已知:AlN + H2O + NaOH→ NaAlO2 + NH3↑)
(1)称取5.00g样品,加入25mL5mol/L的NaOH溶液,共热,样品中AlN和Al2O3完全反应,测得放出氨气1.68L(标准状况)。该样品中的A1N的质量分数为___________。
(2)过滤上述混合溶液,向滤液中滴加2mol/L的盐酸,当滴至202mL时生成的白色沉淀恰好完全消失,5.00g样品中Al2O3的物质的量是多少摩________?(写出计算过程)
碱式碳酸铝镁[MgxAly(OH)a(CO3)b·nH2O]可做为塑料填料。为确定某碱式碳酸铝镁的组成,进行如下实验:
(3)称取3.390g样品与足量稀盐酸充分反应,生成二氧化碳0.560L(标准状况)。3.390g样品中含CO32―________g。
(4)另取100.00g样品在空气中加热,固体质量随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上固体为金属氧化物的混合物)。
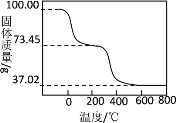
(i)100.00g样品中含结晶水_______mol。
(ii)100.00g样品中OH―的物质的量是多少_______?(写出计算过程)
(iii)通过计算推测该碱式碳酸铝镁的化学式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
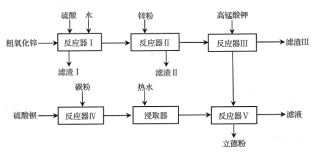
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
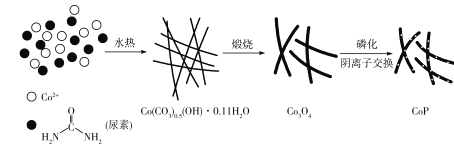
(1)基态P原子的电子排布式为___。P在元素周期表中位于___区。
(2)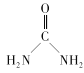 中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
(3)CO32-中C的价层电子对数为___,其空间构型为___。
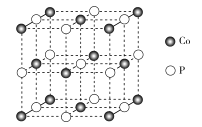
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加德罗常数的值, 则其晶胞密度为___g.cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应: 2NO(g)+2CO(g)N2(g)+2CO2(g)
(1)已知N2(g)+O2(g)2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O |
键能(kJ/mol) | 497 | 803 | 1072 |
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=_____kJ/mol。
(2)在一定温度下,向体积为1L的密闭容器中充入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图所示:
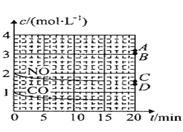
①该反应的平衡常数 K 的计算式为_____;前 10 分钟内用氮气表示的反应速率为_____。
②若保持温度不变,15 分钟时再向该容器中充入1.6molNO、0.4molCO2,则此时反应的ν正______ν逆(填“>”、“=”或“<”)。
③若保持其他条件不变,15min 时压缩容器的体积至 0.5L,20 分钟时反应重新达到平衡,NO 的浓度对应的点应是图中的_____(填字母)。
④某科研小组研究发现以 Ag-ZSM-5 为催化剂,NO 转化为 N2 的转化率随温度变化情况如图所示。若不使用 CO,温度超过775K,发现NO的分解率降低,其可能的原因是__________________
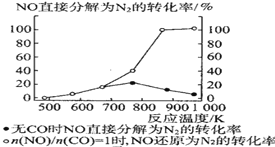
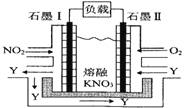
Ⅱ.利用电化学原理,将 NO2、O2和熔融 KNO3制成燃料电池,其原理如图,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅰ附近发生的反应电极反应式为_____相同条件下,消耗的 O2和 NO2的体积比为_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com