
【题目】R是合成某高分子材料的单体,其结构简式如图所示。下列说法错误的是
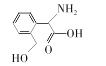
A.R与HOCH2COOH分子中所含官能团完全相同
B.用NaHCO3溶液可检验R中是否含有羧基
C.R能发生加成反应和取代反应
D.R苯环上的一溴代物有4种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有四种有机物:①乙烯 ②2-丙醇 ③ 甲苯 ④ 乙炔,其中:
(1)能发生消去反应的是_________(填序号,下同),其化学方程式是________。
(2)能衡量一个国家的石油化工生产水平的是__________,该物质可用于一种常用塑料,其反应的化学方程式是__________。
(3)能用来制取梯恩梯(TNT)的是________,其发生反应的化学方程式是________。
(4)碳元素的质量百分含量最高的是________,实验室制取该物质的反应装置如下:
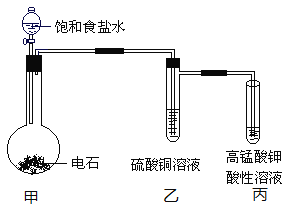
甲中反应的化学方程式是________,滴加饱和食盐水而不直接滴加水的原因是________,乙中硫酸铜溶液的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝有多种化合物,在工业上用途广泛。氮化铝(AlN)中混有碳和氧化铝,为确定某氮化铝样品的纯度,进行如下实验:(已知:AlN + H2O + NaOH→ NaAlO2 + NH3↑)
(1)称取5.00g样品,加入25mL5mol/L的NaOH溶液,共热,样品中AlN和Al2O3完全反应,测得放出氨气1.68L(标准状况)。该样品中的A1N的质量分数为___________。
(2)过滤上述混合溶液,向滤液中滴加2mol/L的盐酸,当滴至202mL时生成的白色沉淀恰好完全消失,5.00g样品中Al2O3的物质的量是多少摩________?(写出计算过程)
碱式碳酸铝镁[MgxAly(OH)a(CO3)b·nH2O]可做为塑料填料。为确定某碱式碳酸铝镁的组成,进行如下实验:
(3)称取3.390g样品与足量稀盐酸充分反应,生成二氧化碳0.560L(标准状况)。3.390g样品中含CO32―________g。
(4)另取100.00g样品在空气中加热,固体质量随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上固体为金属氧化物的混合物)。
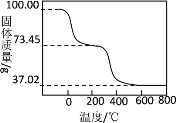
(i)100.00g样品中含结晶水_______mol。
(ii)100.00g样品中OH―的物质的量是多少_______?(写出计算过程)
(iii)通过计算推测该碱式碳酸铝镁的化学式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
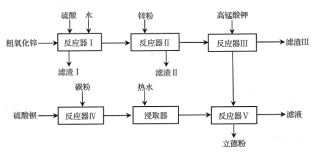
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法
该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡2CrO42-(黄色)+2H+![]() Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色。
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至______。
Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至______。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为______(用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
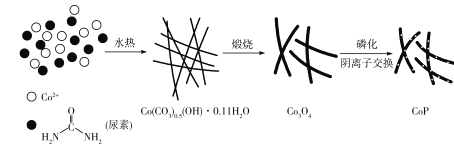
(1)基态P原子的电子排布式为___。P在元素周期表中位于___区。
(2)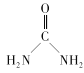 中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
(3)CO32-中C的价层电子对数为___,其空间构型为___。
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加德罗常数的值, 则其晶胞密度为___g.cm-3(列出计算式即可)。
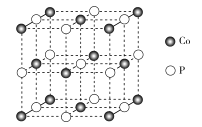
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芥子醇是一种合成工程纤维的单体,结构简式如图。有关芥子醇的说法中正确的是
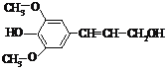
A.能与3 mol NaOH溶液反应
B.能通过与浓溴水的反应证明存在酚羟基
C.能发生的反应类型有氧化、取代、加成
D.能与钠反应、不能与碳酸钠和碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
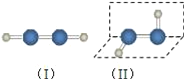
【题目】过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:
(1)过氧化氢的分子结构如图(Ⅱ),则过氧化氢属于__(极性/非极性)分子.过去曾经有人认为过氧化氢的分子结构也可能是(Ⅰ),选择合理实验方法证明过氧化氢的分子结构为(Ⅱ)__(选填编号).
a.测定过氧化氢的沸点
b.测定过氧化氢分解时的吸收的能量
c.测定过氧化氢中H﹣O和O﹣O的键长
d.观察过氧化氢细流是否在电场中偏转
Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢.实验室可用稀硫酸和过氧化物在用冰冷却的条件下反应制取过氧化氢.
(2)上述过氧化物中最适合的是__,反应完毕后__(填操作名称)即可得到双氧水.
(3)若反应时没有用冰冷却,会有气体产生,写出反应的化学方程式__.用酸性高锰酸钾溶液滴定双氧水的方法可以测定双氧水的浓度.
(4)取5.00mL 双氧水样品,配制成250mL溶液.此实验过程必须用到的两种主要仪器为__(填仪器名称).
(5)取25.00mL上述溶液,用0.020mol/L的酸性高锰酸钾溶液滴定,看到__,到达滴定终点,消耗高锰酸钾溶液15.50mL.则原双氧水样品中含过氧化氢__ g/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com