
【题目】阿斯巴甜(结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是

A. 分子式为:C14H18N2O5
B. 阿斯巴甜分子中有3种官能团
C. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
D. 阿斯巴甜的水解产物中有两种氨基酸
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】碳元素与人们的日常生活、生活和科学研究密不可分。请回答下列问题。
(1)Al2O3真空碳热还原一氯化法是一种新的炼铝工艺,该法流程短,设备简单,符合目前国家提倡节能减排、改造升级的大环境。
其中冶炼过程中发生的反应有:
(ⅰ)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1;
(ⅱ)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) △H2;
(ⅲ)3AlCl(g)=AlCl3(g)+2Al(l) △H3;
则Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) △H4=___________________(用含△H1、△H2、△H3的代数式表示)。
(2)利用活性炭的还原性可处理机动车的尾气(氮氧化物),发生如下反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
时间/mim 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
①0~20min内的平均反应速率v(CO2)=_______mol·L-1·min-1;第一次达到平衡的平衡常数K=__________。
②30min时只改变某一条件,则改变的条件可能是______________ (填字母编号)。
a.升高温度 b.降低温度 c.再通入一定量的NO
d.缩小容器的体积 e.加入合适的催化剂 f.增大容器休积
(3)炼钢炉中发生复杂的化学反应,其中包括反应:C(s)+CO2(g)![]() 2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:

CO2体积分数为86%时,CO2的转化率为______________%(结果保留一位小数,下同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2 mol SO2 和 1 mol O2 充入2L密闭容器中,在催化剂存在下进行下列反应: 2SO2+ O2 ![]() 2SO3,下列说法中正确的是
2SO3,下列说法中正确的是
A. 达到反应限度时,生成2molSO3
B. 达到反应限度时SO2的消耗速率必定等于O2的生成速率
C. 达到反应限度时SO2、O2、SO3的分子数之比一定为2∶1∶2
D. SO2和SO3物质的量之和一定为 2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质随着原子序数的递增呈周期性变化的原因是
A. 元素的化合价的周期性变化
B. 元素原子的原子半径的周期性变化
C. 元素原子的核外电子排布的周期性变化
D. 元素原子的电子层数的周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系曲线不能正确反映其对应变化关系的是( )
A. 加热KClO3和MnO2固体混合物
B. 向Ca(OH)2溶液中通入CO2至过量(碳酸钙遇到溶有二氧化碳的水,能生成可溶性碳酸氢钙) 
C. 向一定浓度的NaOH溶液中加水稀释
D. 将等质量的Mg和Al分别与过量等浓度的盐酸反应,则a为Mg,b为Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)
A.乙炔B.丙炔C.丁炔D.1,3﹣丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为研究生铁(含少量碳)与浓硫酸的反应情况及产物性质,设计如下实验装置(夹持装置及尾气处理装置未画出)。请回答下列问题:
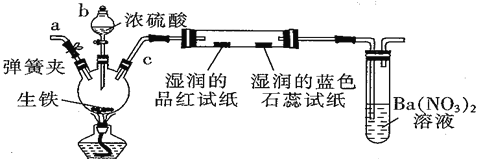
A B C
(1)仪器b 的名称为____________,按照上图装置进行实验,实验过程中,装置B中的现象是湿润的品红试纸__________________,湿润的蓝色石蕊试纸____________ 。若观察到装置C中会出现白色沉淀,原因是_____________________________。
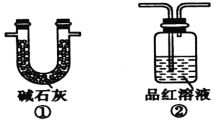

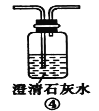
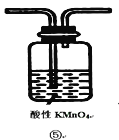
(2)装置A中还会产生能够使得澄清石灰水变浑浊的另一种气体,请写出产生该气体的化学方程式____________________________为了验证该气体,应从下列①~⑤中选出必要的装置连接装置A中出口C处,从左到右的顺序是_____________(填序号),连接好装置,然后打开弹簧夹a,多次鼓入N2,其目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.含金属元素的离子一定是阳离子
B.在氧化还原反应中,非金属单质一定是还原剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银的冶炼有很多方法, 在《 天工开物》 均有记载, 而现代流行的“ 氰化法”, 用 NaCN溶液浸出矿石中的银的方法是最常用的方法。 该方法具备诸多优点: 银的回收率高; 对游离态和化合态的银均能浸出; 对能源消耗相对较少; 生产工艺简便等, 但氰化物通常有毒。 其炼制工艺简介如下:

(1)矿石需要先进行破碎、 研磨, 其目的是__________。
(2)写出该工艺的一个明显的缺点__________ 。
(3)用 NaCN 浸泡矿石( 该矿石是辉银矿, 其主要成分是 Ag2S) 时, 反应容器处于开口状态, 产生的银以[Ag(CN)2]- 形式存在, 硫元素被氧化至最高价, 试写出主要反应的离子方程式__________。
(4)银往往和锌、 铜、 金等矿伴生, 故氰化法得到的银中往往因含有上述金属而不纯净, 需要进一步纯化, 从而获得纯净的银。 其中方法之一就是进行电解精炼, 在精炼过程中, 含有杂质的银作__________极( 填“阴” 或“阳”), 该电极上发生的主要反应式为__________, 金以__________形式存在。
(5)有人提出了另外的提纯银的方案, 先将锌粉还原后的混合金属用略过量的硝酸溶解, 通过精确调整溶液的 pH 来进行金属元素分离, 已知:
①溶解后的离子浓度如下表:
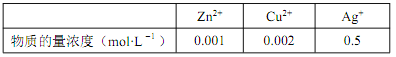
②某些金属离子的氢氧化物 Ksp如下:
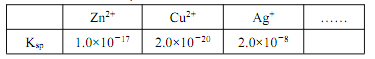
( 已知 lg2=0.3),该设计方案_______(填“ 可行” 或“ 不可行”),其原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com