
【题目】某化学兴趣小组为研究生铁(含少量碳)与浓硫酸的反应情况及产物性质,设计如下实验装置(夹持装置及尾气处理装置未画出)。请回答下列问题:
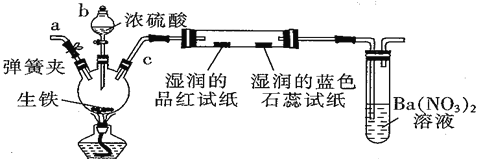
A B C
(1)仪器b 的名称为____________,按照上图装置进行实验,实验过程中,装置B中的现象是湿润的品红试纸__________________,湿润的蓝色石蕊试纸____________ 。若观察到装置C中会出现白色沉淀,原因是_____________________________。
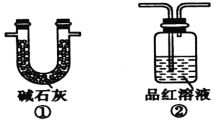

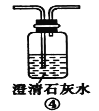
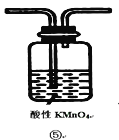
(2)装置A中还会产生能够使得澄清石灰水变浑浊的另一种气体,请写出产生该气体的化学方程式____________________________为了验证该气体,应从下列①~⑤中选出必要的装置连接装置A中出口C处,从左到右的顺序是_____________(填序号),连接好装置,然后打开弹簧夹a,多次鼓入N2,其目的是________________________________。
【答案】分液漏斗 褪色 变红 SO2水溶液呈酸性,NO3-在酸性条件下使之氧化为SO42-,结合Ba2+生成BaSO4. C+2H2SO4(浓)![]() 2H2O+CO2↑+2SO2↑ ⑤②④或⑤④ 赶尽装置中的空气,防止空气中的CO2干扰实验
2H2O+CO2↑+2SO2↑ ⑤②④或⑤④ 赶尽装置中的空气,防止空气中的CO2干扰实验
【解析】
(1)由装置图可知,生铁中的铁和碳在装置A中与浓硫酸共热反应,生成硫酸铁、二氧化硫、二氧化碳和水,反应生成的二氧化硫具有漂白性,能使装置B中湿润的品红试纸漂白褪色,二氧化硫和二氧化碳是酸性氧化物,与水反应生成酸,能使装置B中湿润的蓝色石蕊试纸变红色,NO3-在酸性条件下将二氧化硫氧化生成硫酸,硫酸与硝酸钡反应生成硫酸钡沉淀;
(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳;由于装置有空气,空气中含有二氧化碳,开始鼓入氮气,排尽装置中的空气。
(1)由装置图可知,仪器b为分液漏斗,生铁(含碳)与浓硫酸共热反应生成硫酸铁、二氧化硫、二氧化碳和水,反应生成的二氧化硫具有漂白性,可使湿润的品红试纸褪色,二氧化硫和二氧化碳是酸性氧化物,与水反应生成酸,湿润的石蕊试纸变红;NO3-在酸性条件下将二氧化硫氧化生成硫酸,硫酸与硝酸钡反应生成硫酸钡沉淀,故答案为:分液漏斗;品红试纸褪色,石蕊试纸变红;SO2水溶液呈酸性,NO3-在酸性条件下使之氧化为SO42-,结合Ba2+生成BaSO4;
(2)装置A中碳也与浓硫酸反应生成二氧化碳、二氧化硫与水,反应方程式为C+2H2SO4(浓)![]() 2H2O+CO2↑+2SO2↑;二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,则从左到右的顺序为⑤②④;空气中二氧化碳会干扰反应生成二氧化碳的检验,加热前打开弹簧夹a,目的是赶尽装置中的空气,防止空气中的CO2干扰实验,故答案为:C+2H2SO4(浓)
2H2O+CO2↑+2SO2↑;二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,则从左到右的顺序为⑤②④;空气中二氧化碳会干扰反应生成二氧化碳的检验,加热前打开弹簧夹a,目的是赶尽装置中的空气,防止空气中的CO2干扰实验,故答案为:C+2H2SO4(浓)![]() 2H2O+CO2↑+2SO2↑;⑤②④;赶尽装置中的空气,防止空气中的CO2干扰实验。
2H2O+CO2↑+2SO2↑;⑤②④;赶尽装置中的空气,防止空气中的CO2干扰实验。


科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期律产生的根本原因就是随着元素原子序数的递增
A. 元素的相对原子质量逐渐增大
B. 核外电子排布呈周期性变化
C. 原子半径呈周期性变化
D. 元素主要化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是

A. 分子式为:C14H18N2O5
B. 阿斯巴甜分子中有3种官能团
C. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
D. 阿斯巴甜的水解产物中有两种氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4,同时获得副产品甲的工业生产流程如下:
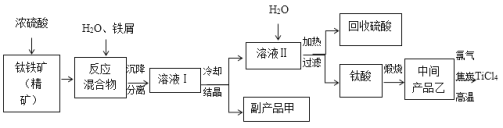
(1)已知酸浸反应FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O,则FeTiO3中铁元素的化合价为___________。
(2)上述生产流程中加入铁屑的目的是使Fe3+还原为Fe2+,且反应得到的溶液中含钛元素的离子只有TiO2+,该过程发生的主要反应有:
①2Fe3++Fe===3Fe2+ ; ②2TiO2++Fe+4H+===2Ti3++Fe2++2H2O;③______________________________________。
(3)加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________________。
(4)由TiO2·nH2O胶体制得固体TiO2·nH2O,再用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=___________________。
Fe3++3H2O的平衡常数K=___________________。
(5)可循环利用的物质是_________,副产品甲含结晶水,其化学式是_______________。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用___________方法。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:

(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是__________设计简单实验检验绿矾是否变质,简述你的操作:__________。
(2)步骤Ⅰ中加入过量铁粉的目的是__________,步骤Ⅱ中__________(填“能”或“不能”)用盐酸代替硫酸。
(3)步骤V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案__________不好;从产品纯度考虑,方案__________不好。
(4)写出步骤Ⅱ中涉及反应的离子方程式:__________;步骤Ⅳ得到绿矾的操作蒸发浓缩__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A. K2和K1的单位均为mol·L-1
B. K2>K1
C. c2(CO)=c2(H2O)
D. c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业需要高纯硅,粗硅中含有SiO2、Fe2O3、CuO、C等杂质,提纯硅的方法比较多,其中三氯氢硅(有一定毒性)氢还原法和四氯化硅氢还原法应用较为广泛,下面是实验室模拟工业上三氯氢硅氢还原法的基本原理:
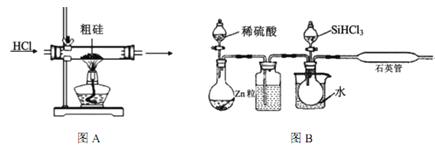
已知:①Si+3HCl ![]() SiHCl3+H2(主要反应)
SiHCl3+H2(主要反应)
Si+4HCl![]() SiCl4+2H2(次要反应)
SiCl4+2H2(次要反应)
2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②典型硅的重要化合物的部分性质如下表:
熔点(℃) | 沸点(℃) | 溶解性 | |
SiHCl3 | -127 | 33 | 易溶于多数有机溶剂 |
SiCl4 | -23 | 77 | 易溶于多数有机溶剂 |
(1)粗硅在提纯前,需要进行酸、碱预处理,其目的是___________________________________。
(2)下列装置在实验室可用于制备HCl气体的是_____(填字母代号)。
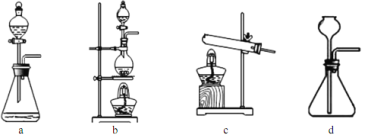
(3)在1100~1200℃条件下,利用图B在石英管中可以获得硅,写出该反应的方程式_______;其烧杯中水的作用是__________________________;该装置使用石英管而不是普通玻璃管的原因是_________。
(4)三氯氢硅氢还原法用 SiHCl3在图B中制硅,不足之处有_______________(任意回答一点即可)。
(5)SiCl4与氢气反应也能得到硅,但反应所需温度不同,在工业上往往将三氯氢硅中混入的SiCl4分离后再与氢气反应,你认为最好的分离方法是______________。
(6)工业上如果用四氯化硅氢还原法制硅,其原理如下:![]() 该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com