
【题目】银的冶炼有很多方法, 在《 天工开物》 均有记载, 而现代流行的“ 氰化法”, 用 NaCN溶液浸出矿石中的银的方法是最常用的方法。 该方法具备诸多优点: 银的回收率高; 对游离态和化合态的银均能浸出; 对能源消耗相对较少; 生产工艺简便等, 但氰化物通常有毒。 其炼制工艺简介如下:

(1)矿石需要先进行破碎、 研磨, 其目的是__________。
(2)写出该工艺的一个明显的缺点__________ 。
(3)用 NaCN 浸泡矿石( 该矿石是辉银矿, 其主要成分是 Ag2S) 时, 反应容器处于开口状态, 产生的银以[Ag(CN)2]- 形式存在, 硫元素被氧化至最高价, 试写出主要反应的离子方程式__________。
(4)银往往和锌、 铜、 金等矿伴生, 故氰化法得到的银中往往因含有上述金属而不纯净, 需要进一步纯化, 从而获得纯净的银。 其中方法之一就是进行电解精炼, 在精炼过程中, 含有杂质的银作__________极( 填“阴” 或“阳”), 该电极上发生的主要反应式为__________, 金以__________形式存在。
(5)有人提出了另外的提纯银的方案, 先将锌粉还原后的混合金属用略过量的硝酸溶解, 通过精确调整溶液的 pH 来进行金属元素分离, 已知:
①溶解后的离子浓度如下表:
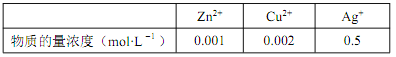
②某些金属离子的氢氧化物 Ksp如下:
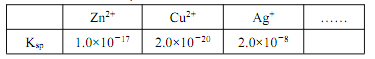
( 已知 lg2=0.3),该设计方案_______(填“ 可行” 或“ 不可行”),其原因是_______。
【答案】增大接触面积,增大反应速率 NaCN有剧毒,会污染环境(生成有毒HCN,生产工艺不环保,对环境不友好等) Ag2S+4CN-+2O2=2[Ag(CN)2]-+SO42- 阳 Ag-e-=Ag+、 Zn-2e-=Zn2+ 、 Cu-2e-=Cu2+ 阳极泥 不可行 在调整溶液的 pH 时,各离子的沉淀pH相近,难以逐一沉淀
【解析】
根据流程图分析各操作的作用解操作的合理性;根据电解池原理书写电极反应及判断阴阳极;根据溶度积分析沉淀产生的先后。
(1)矿石需要先进行破碎、 研磨, 其目的是增大接触面积,增大反应速率;
(2)根据题干提示,氰化物有毒,所以该工艺的一个明显的缺点是NaCN有剧毒,会污染环境;
(3)根据提示反应的离子方程式为:Ag2S+4CN-+2O2=2[Ag(CN)2]-+SO42-;
(4)根据电解的原理,要除去杂质,需要将银溶解,故将有杂质的银作阳极,使其失电子,该电极上发生的主要反应式为:Ag-e-=Ag+、 Zn-2e-=Zn2+ 、 Cu-2e-=Cu2+;金活泼性不及Ag,金不会失电子,最终会在阳极下面以阳极泥的形式存在,故答案为:阳,Ag-e-=Ag+、 Zn-2e-=Zn2+ 、 Cu-2e-=Cu2+;阳极泥;
(5)由Zn(OH)2(s)![]() Zn2+(aq)+2OH-(aq)得:Ksp=c(Zn2+)c2(OH-),当锌离子开始沉淀时c(OH-)=
Zn2+(aq)+2OH-(aq)得:Ksp=c(Zn2+)c2(OH-),当锌离子开始沉淀时c(OH-)=![]() =
=![]() =10-7,pH=7;当Zn2+完全沉淀时c(OH-)=
=10-7,pH=7;当Zn2+完全沉淀时c(OH-)=![]() =10-6,pH=8;
=10-6,pH=8;
由Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq)得,当铜离子开始沉淀时c(OH-)=
Cu2+(aq)+2OH-(aq)得,当铜离子开始沉淀时c(OH-)=![]() =
=![]() =10-8.5,pH=5.5;当Cu2+完全沉淀时c(OH-)=
=10-8.5,pH=5.5;当Cu2+完全沉淀时c(OH-)=![]() =
=![]() ,pH=6.65;
,pH=6.65;
由AgOH(s)![]() Ag+(aq)+OH-(aq)得,当银离子开始沉淀时c(OH-)=Ksp/c(Ag+)=2.0
Ag+(aq)+OH-(aq)得,当银离子开始沉淀时c(OH-)=Ksp/c(Ag+)=2.0![]() 10-8/0.5=4
10-8/0.5=4![]() 10-8,pH=6.6;当Ag+完全沉淀时c(OH-)=2.0
10-8,pH=6.6;当Ag+完全沉淀时c(OH-)=2.0![]() 10-8/10-5=2×10-3,pH=11.3;
10-8/10-5=2×10-3,pH=11.3;
根据以上数据,该方案不可行,因为在调整溶液的 pH 时,各离子的沉淀pH相近,难以逐一沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】阿斯巴甜(结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是

A. 分子式为:C14H18N2O5
B. 阿斯巴甜分子中有3种官能团
C. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
D. 阿斯巴甜的水解产物中有两种氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,某些主族元素与右下方主族元素的有些性质是相似的,被称为“对角线”规则,如:Li和Mg、Be和Al、B和Si。下列说法不正确的是
A. Li在N2中燃烧生成Li3N B. LiOH是极易溶的强碱
C. Be(OH)2既能溶于强酸又能溶于强碱溶液 D. 硼酸钠溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
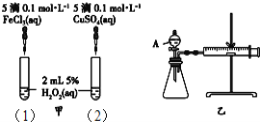
A. 实验中H2O2分解的速率为(1)>(2)
B. 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率
C. H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0
D. 图甲中(1)、(2)两个实验中H2O2分解的△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用50mL0.50molL-1盐酸、50mL0.55molL-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 23.9 |
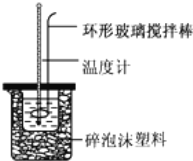
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 _________________ .
(2)在操作正确的前提下,提高中和热测定准确性的关键是 ______ .大烧杯如不盖硬纸板,求得的中和热数值将 ______ (填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在 ______ 中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= ________
[盐酸和NaOH溶液的密度按1gcm-3计算,反应后混合溶液的比热容(c)按4.18J(g℃)-1计算].
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 ______ (填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL0.55molL-1的NaOH溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”或“不相等”),所求中和热 ______ (填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是 __________ .
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业需要高纯硅,粗硅中含有SiO2、Fe2O3、CuO、C等杂质,提纯硅的方法比较多,其中三氯氢硅(有一定毒性)氢还原法和四氯化硅氢还原法应用较为广泛,下面是实验室模拟工业上三氯氢硅氢还原法的基本原理:
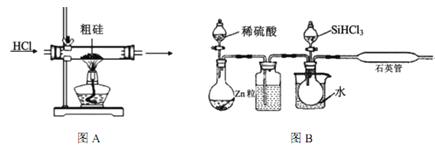
已知:①Si+3HCl ![]() SiHCl3+H2(主要反应)
SiHCl3+H2(主要反应)
Si+4HCl![]() SiCl4+2H2(次要反应)
SiCl4+2H2(次要反应)
2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②典型硅的重要化合物的部分性质如下表:
熔点(℃) | 沸点(℃) | 溶解性 | |
SiHCl3 | -127 | 33 | 易溶于多数有机溶剂 |
SiCl4 | -23 | 77 | 易溶于多数有机溶剂 |
(1)粗硅在提纯前,需要进行酸、碱预处理,其目的是___________________________________。
(2)下列装置在实验室可用于制备HCl气体的是_____(填字母代号)。
(3)在1100~1200℃条件下,利用图B在石英管中可以获得硅,写出该反应的方程式_______;其烧杯中水的作用是__________________________;该装置使用石英管而不是普通玻璃管的原因是_________。
(4)三氯氢硅氢还原法用 SiHCl3在图B中制硅,不足之处有_______________(任意回答一点即可)。
(5)SiCl4与氢气反应也能得到硅,但反应所需温度不同,在工业上往往将三氯氢硅中混入的SiCl4分离后再与氢气反应,你认为最好的分离方法是______________。
(6)工业上如果用四氯化硅氢还原法制硅,其原理如下:![]() 该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000mol·L-1 NaOH溶液滴定 20.00mL0.1000mol·L-1某一元酸HA溶液,滴定曲线如图。下列说法正确的是( )
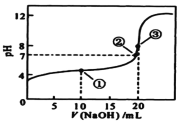
A. HA是强电解质
B. 点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C. 点②所示溶液中:c(Na+) =c(HA) +c(A-)
D. 水的电离程度随着NaOH溶液的滴入,不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化物有剧毒,我国工业废水中氰化物(CN-)的最高允许排放浓度为0.5 mg/L。对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水中的CN-转化成N2和CO2等,使废水得到净化。发生的反应为2CN-+8OH-+5Cl2===2CO2+N2+10Cl-+4H2O。下列有关说法不正确的是( )
A. 上述反应中氧化产物有N2和CO2
B. 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离
C. 若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2 mol
D. 现取1 L含CN-1.02 mg/L的废水,至少需用5.0×10-5 mol Cl2处理后才符合排放标准
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com