
【题目】探究新制饱和氯水成分的实验时,由实验现象得出的结论错误的是
A.氯水呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含Cl-
C.向氯水中滴加NaHCO3,有气泡产生,说明氯水中含有HCl和HClO
D.向FeCl2溶液中滴加氯水,溶液变成棕黄色,说明氯水中含有HClO
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器中,可逆反应A(s)![]() B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组以二氧化锰和浓盐酸为反应物,连接装置A→B→C制取氯水,并探究氯气和水反应的产物。
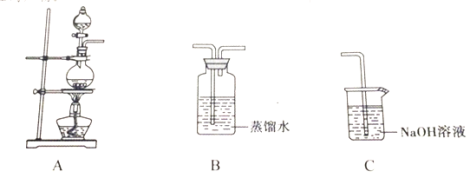
(1)A中发生反应的离子方程式是_________。
(2)B中得到浅黄绿色的饱和氯水,将所得氯水分三等份,进行的操作、现象、结论如下:
实验 | 实验操作 | 现象 | 结论 |
Ⅰ | 向氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生了一种酸性强于碳酸的物质 |
Ⅱ | 向品红溶液中滴入氯水 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
(1)甲同学指出:由实验Ⅰ得出的结论不合理,原因是制取的氯水中含有杂质______(填化学式),也能与碳酸氢钠反应产生气泡。应在A、B间连接除杂装置,请画出除杂装置并标出气体流向和药品名称______。
(2)乙同学指出由实验Ⅱ得出的结论不合理,原因是实验未证明_______(填化学式)是否有漂白性。
(3)丙同学利用正确的实验装置发现氯水中有Cl-存在,证明氯水中有Cl-的操作和现象是:_____。丙同学认为,依据上述现象和守恒规律,能推测出氯水中有次氯酸存在。这一推测是否正确,请说明理由________。
(4)丁同学利用正确的实验装置和操作进行实验,观察到实验现象与实验Ⅰ、Ⅱ相似,说明氯气和水反应的产物具有的性质是________。
(5)戊同学将第三份氯水分成两等份,向其中一份加入等体积的蒸馏水,溶液接近无色。另一份中加入等体积饱和的氯化钠溶液,溶液为浅黄绿色。对比这两个实验现象能说明:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是

A.在0-50min之间, pH =2 和 PH= 7 时 R 的降解百分率相等
B.溶液酸性越强, R 的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在 20-25min之间, pH = 10 时 R 的平均降解速率为 0.04mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)![]() C8H8(g)+H2(g)△H=120kJmol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
C8H8(g)+H2(g)△H=120kJmol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
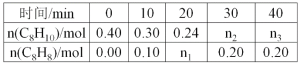
(1)当反应进行到20min时,该段时间内H2的平均反应速率是__。
(2)该温度下,反应的平衡常数表达式是K=____,K的值是__。
(3)若保持其他条件不变,用0.50molH2(g)和0.50molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__,此时,该合成反应是否达到了平衡状态?__(填“是”或“否”),且正反应速率__逆反应速率(填大于、小于或等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是资源宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。完成下列填空:
(1)氯离子原子核外有_____种不同运动状态的电子、有____种不同能量的电子。
(2)溴在周期表中的位置_________。
(3)卤素单质及其化合物在许多性质上都存在递变规律,请说明下列递变规律的原因。
① 熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是______________。
② 还原性按Cl—、Br—、I—的顺序依次增大,原因是____________。
(4)已知X2 (g) + H2 (g)![]() 2HX (g) + Q(X2 表示Cl2、Br2),如图表示上述反应的平衡常数K与温度T的关系。
2HX (g) + Q(X2 表示Cl2、Br2),如图表示上述反应的平衡常数K与温度T的关系。

① Q表示X2 (g)与H2 (g)反应的反应热,Q_____0(填“>”、“<”或“=”)。
② 写出曲线b表示的平衡常数K的表达式,K=______(表达式中写物质的化学式)。
(5)(CN)2是一种与Cl2性质相似的气体,在(CN)2中C显+3价,N显-3价,氮元素显负价的原因_________,该分子中每个原子都达到了8电子稳定结构,写出(CN)2的电子式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+
B.滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42-
C.![]() =1013的溶液:Fe2+、Cl-、MnO4-、SO42-
=1013的溶液:Fe2+、Cl-、MnO4-、SO42-
D.使红色石蕊试纸变蓝色的溶液:Na+、ClO-、Cl-、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是( )
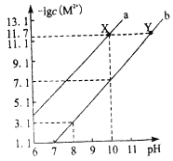
A.曲线b表示Cu(OH)2饱和溶液中的变化关系
B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)KCl(l)+NaAlSi3O8(s)+Q.填空:
(1)写出Cl原子的核外电子排布式____,NaCl的熔点比KCl______ (选填“高”或“低”).
(2)指出钾长石中存在的化学键类型______.
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,该元素是_____.
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量 占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得数据曲线如图.

①分析数据可知,Q__0(选填“>”或“<”).
②950℃时,欲提高钾的熔出速率可以采取的措施是__(填序号).
a.延长反应时间
b.充分搅拌
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
③要使钾元素的熔出率和熔出速率都达到最大,反应温度应为__.
(5)工业上常用KCl冶炼金属钾.反应方程式为:Na(l)+KCl(l)NaCl(l)+K(g)用平衡移动原理解释该方法可行的原因:_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com