
【题目】海水是资源宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。完成下列填空:
(1)氯离子原子核外有_____种不同运动状态的电子、有____种不同能量的电子。
(2)溴在周期表中的位置_________。
(3)卤素单质及其化合物在许多性质上都存在递变规律,请说明下列递变规律的原因。
① 熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是______________。
② 还原性按Cl—、Br—、I—的顺序依次增大,原因是____________。
(4)已知X2 (g) + H2 (g)![]() 2HX (g) + Q(X2 表示Cl2、Br2),如图表示上述反应的平衡常数K与温度T的关系。
2HX (g) + Q(X2 表示Cl2、Br2),如图表示上述反应的平衡常数K与温度T的关系。

① Q表示X2 (g)与H2 (g)反应的反应热,Q_____0(填“>”、“<”或“=”)。
② 写出曲线b表示的平衡常数K的表达式,K=______(表达式中写物质的化学式)。
(5)(CN)2是一种与Cl2性质相似的气体,在(CN)2中C显+3价,N显-3价,氮元素显负价的原因_________,该分子中每个原子都达到了8电子稳定结构,写出(CN)2的电子式_____。
【答案】18 5 第四周期、ⅦA(都对得1分) F2、Cl2、Br2、I2都是分子晶体,相对分子质量依次增大,分子间作用力依次增强。 从Cl-、Br-、I-半径依次增大,失电子的能力依次增强,还原性依次增大 > K=![]() 氮原子半径小于碳原子,氮原子吸引电子的能力比碳原子强,氮和碳之间共用电子对偏向氮原子,氮显负价
氮原子半径小于碳原子,氮原子吸引电子的能力比碳原子强,氮和碳之间共用电子对偏向氮原子,氮显负价 ![]()
【解析】
![]() 氯离子原子核外有18个电子,为不同的运动状态,处于5种不同的轨道,故答案为:18;5;
氯离子原子核外有18个电子,为不同的运动状态,处于5种不同的轨道,故答案为:18;5;
![]() 溴与氯在同一主族,核电荷数为35,在周期表中第四周期、ⅦA,故答案为:第四周期、ⅦA;
溴与氯在同一主族,核电荷数为35,在周期表中第四周期、ⅦA,故答案为:第四周期、ⅦA;
![]() 、
、![]() 、
、![]() 、
、![]() 的相对分子质量逐渐增大,且都属于分子晶体,单质的相对分子质量越大,则熔点越高,故答案为:
的相对分子质量逐渐增大,且都属于分子晶体,单质的相对分子质量越大,则熔点越高,故答案为:![]() 、
、![]() 、
、![]() 、
、![]() 都是分子晶体,相对分子质量依次增大,分子间作用力依次增强;
都是分子晶体,相对分子质量依次增大,分子间作用力依次增强;
![]() 元素的非金属性越强,对应的阴离子的还原性越强,非金属性
元素的非金属性越强,对应的阴离子的还原性越强,非金属性![]() ,
,![]() 、
、![]() 、
、![]() 半径依次增大,失电子的能力依次增强,还原性依次增大,故答案为:从
半径依次增大,失电子的能力依次增强,还原性依次增大,故答案为:从![]() 、
、![]() 、
、![]() 半径依次增大,失电子的能力依次增强,还原性依次增大;
半径依次增大,失电子的能力依次增强,还原性依次增大;
![]() 由图象可知,升高温度平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,
由图象可知,升高温度平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,![]() ,故答案为:
,故答案为:![]() ;
;
![]() 同一温度时,a曲线的K值最大,说明卤素单质与氢气化合的能力最强,Cl2、Br2中Cl2的氧化性最强,所以最易与氢气化合的是氯气,所以b曲线表示Br2与H2反应时K与t的关系.平衡常数等于生成物与反应物的浓度幂之积,K=
同一温度时,a曲线的K值最大,说明卤素单质与氢气化合的能力最强,Cl2、Br2中Cl2的氧化性最强,所以最易与氢气化合的是氯气,所以b曲线表示Br2与H2反应时K与t的关系.平衡常数等于生成物与反应物的浓度幂之积,K=![]() ,故答案为:
,故答案为:![]() ;
;
![]() 的非金属性较C强,氮原子吸引电子的能力比碳原子强,氮和碳之间共用电子对偏向氮原子,氮显负价,电子式为
的非金属性较C强,氮原子吸引电子的能力比碳原子强,氮和碳之间共用电子对偏向氮原子,氮显负价,电子式为![]() ,故答案为:氮原子半径小于碳原子,氮原子吸引电子的能力比碳原子强,氮和碳之间共用电子对偏向氮原子,氮显负价;
,故答案为:氮原子半径小于碳原子,氮原子吸引电子的能力比碳原子强,氮和碳之间共用电子对偏向氮原子,氮显负价;![]() 。
。


科目:高中化学 来源: 题型:
【题目】某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸溶液在室温下进行反应。实验中所用的草酸为稀溶液,可视为强酸。
(1)将高锰酸钾氧化草酸的离子方程式补充完整。
2MnO4- +_______C2O42- +_____ _____=2Mn2+ +______CO2↑ +_______H2O
(2)该小组进行了实验I,数据如下。
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率______。但分析实验数据,得到的结论是______。
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如下。
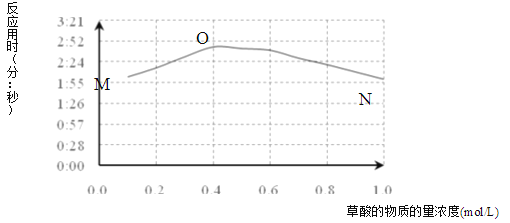
①用文字描述曲线图表达的信息______。
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是______。
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II)。(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物。 |
c | 草酸稳定性较差,加热至185℃可分解。 |
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如下。
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是______。
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因______。为验证该推测还需要补充实验,请对实验方案进行理论设计______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素。请回答下列问题:
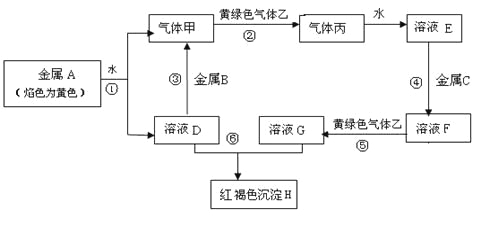
(1)写出金属B和气体丙的化学式______________、___________。
(2)写出反应①的化学反应方程式__________________________。
写出反应⑥的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]()
![]() ,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高
,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高![]() 转化率的是( )
转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究新制饱和氯水成分的实验时,由实验现象得出的结论错误的是
A.氯水呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含Cl-
C.向氯水中滴加NaHCO3,有气泡产生,说明氯水中含有HCl和HClO
D.向FeCl2溶液中滴加氯水,溶液变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
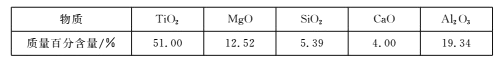
【题目】用钒钛磁铁矿为原料冶炼铁,产生一种固体废料,主要成分如下表。
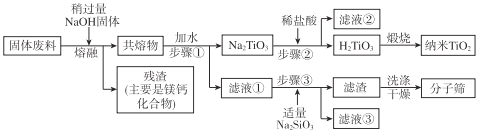
通过下列工艺流程可以实现元素Ti、Al、Si的回收利用,并得到纳米二氧化钛和分子筛。
请回答下列问题:
(1)步骤①②③中所用的玻璃仪器___。
(2)下列固体废料的成分中,不属于碱性氧化物的是___(填字母序号)。
a.TiO2 b.SiO2 c.MgO d.CaO
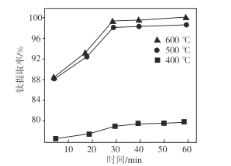
(3)熔融温度和钛的提取率关系如图,适宜温度为500℃,理由是___。
(4)滤液①中溶质的主要成分是___。
(5)步骤②中发生反应的离子方程式是___。
(6)将步骤③中制取分子筛的化学方程式补充完整:
![]() ___+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+
___+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+![]() ___
___
根据成分表中数据,计算100kg固体废料,理论上应再加入Na2SiO3物质的量的计算式是n(Na2SiO3)=___mol(摩尔质量/g/mol:SiO2-60,Al2O3-102)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是
选项 | 用途 | 性质 |
A | 液氨作制冷剂 | NH3分解生成N2和H2的反应是吸热反应 |
B | NH4Fe(SO4)2·12H2O常作净水剂 | NH4Fe(SO4)2·12H2O具有氧化性 |
C | 漂粉精可以作环境消毒剂 | 漂粉精溶液中ClO-和HClO都有强氧化性 |
D | Al2O3常作耐高温材料 | Al2O3,既能与强酸反应,又能与强碱反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
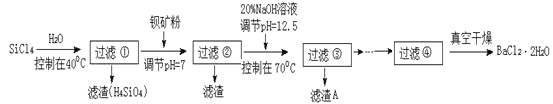
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为_________________________________________________。过滤操作需要的玻璃仪器有_________________________________。
(2)加钡矿粉调节pH=7的作用是________________________、_______________________。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________。
(4)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_________吨。实际产量为9.70吨,相对误差为__________________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用酚酞作指示剂,用 0.10mol·L-1NaOH 溶液分别滴定 20.00mL 浓度均为0.10mol·L-1的CH3COOH 溶液和 HCN 溶液所得滴定曲线如图。(已知电离平衡常数:CH3COOH> HCN)
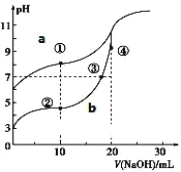
(1)图_____(a 或 b)是 NaOH 溶液滴定 HCN 溶液的 pH 变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:_____ 。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)_____c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)25 ℃时,用 0.1 mol·L-1的醋酸溶液滴定 20 mL 0.1 mol·L-1 的 NaOH 溶液,当滴加V mL 该醋酸溶液时, 混合溶液的 pH = 7 。已知醋酸的电离平衡常数为 Ka , 则Ka=________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com