
【题目】以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
A.阳极反应式相同
B.电解结束后所得液体的pH相同
C.阴极反应式相同
D.通过相同电量时生成的气体总体积相等(同温同压)
【答案】C
【解析】
A.以石墨为电极电解水,阳极反应式为4OH--4e-=2H2O+O2↑,以石墨为电极电解饱和食盐水,阳极反应式为2Cl--2e-=Cl2↑,阳极的电极反应式不同,故A错误;
B.电解水时其pH在理论上是不变的,但若加入少量硫酸则变小,若加入少量氢氧钠则变大,若加入硫酸钠则不变;电解饱和氯化钠溶液生成氢氧化钠和氯气和氢气,pH变大,所以电解结束后所得液体的pH不相同,故B错误;
C.以石墨为电极电解水和饱和食盐水的阴极反应式为:2H++2e-=H2↑,所以电极反应式相同,故C正确;
D.若转移电子数为4mol,则依据电解方程式2H2O![]() 2H2↑+O2↑~4e-,电解水生成3mol气体;依据电解方程式2NaCl+2H2O
2H2↑+O2↑~4e-,电解水生成3mol气体;依据电解方程式2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑~2e-,电解食盐水生成4mol气体,在同温同压下气体的总体积不相等,故D错误;
2NaOH+Cl2↑+H2↑~2e-,电解食盐水生成4mol气体,在同温同压下气体的总体积不相等,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB投入容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )
xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )
A. x=2
B. 2min时,B的浓度为0.4mol/L
C. 0~2min内B的反应速率为0.2mol·L-·min-
D. 此时A的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离提纯中除杂剂及相应的化学方程式分别为:
混合物成分 | 除杂试剂 | 化学方程式 |
(i)铜粉中混有铁粉 | __ | __ |
(ii)铁粉中混有铝粉 | __ | __ |
(iii)Al2O3中混有Al(OH)3 | __ | __ |
(iv)FeCl3溶液中混有FeCl2 | __ | __ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是![]()
A.![]() 水解:
水解:![]()
B.用惰性电极电解饱和NaCl溶液:![]()
![]()
![]()
C.![]() 溶液中通入足量的
溶液中通入足量的![]() :
:![]()
D.等体积等物质的量浓度的![]() 与NaOH溶液反应:
与NaOH溶液反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2和MgC2都是离子化合物,下列叙述正确的是( )
①CaC2和MgC2都跟水反应生成乙炔
②C![]() 的电子式为
的电子式为![]()
③CaC2在水中以Ca2+和C![]() 形式存在
形式存在
④MgC2的熔点低,可能在100℃以下
A.①②B.②④C.①③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A.KH2PO4溶于水:H2PO4-![]() 2H++PO43-
2H++PO43-
B.NaHS溶于水:NaHS=Na++HS-,HS-![]() H++S2-
H++S2-
C.HF溶于水:HF=H++F-
D.NH4Cl溶于水:NH4Cl![]() NH4++Cl- ,NH4++H2O
NH4++Cl- ,NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
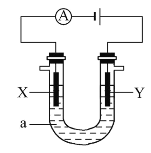
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______,在X极附近观察到的现象是_________
②Y电极上的电极反应式为_____________ 检验该电极反应产物的方法及现象是__________
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_________________电极反应式是_________________。
②Y电极的材料是___________电极反应式是__________________。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A.抽动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言自然界中可能存在原子序数为114号的稳定同位素![]() X,根据原子结构理论和元素周期律下列预测错误的是
X,根据原子结构理论和元素周期律下列预测错误的是
A.![]() X位于第七周期,第ⅣA 族B.X是金属元素
X位于第七周期,第ⅣA 族B.X是金属元素
C.XO2是酸性氧化物D.X元素的化合价有+2和+4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com