
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
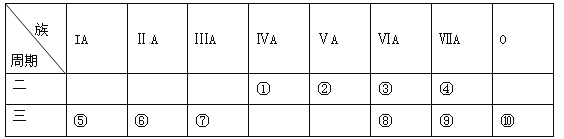
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是____________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______(填元素符号),判断的实验依据是_______(写出一种)。
【答案】(1)F,C;
(2)Cl,NaOH,Al(OH)3;
(3)Na>Mg>Al
【解析】试题分析:根据这几种元素在周期表中的位置可知①号元素是C元素,②号是N元素,③号是O元素,④号是F元素,⑤号是Na元素,⑥号是Mg元素,⑦号是Al元素,⑧号是S元素,⑨号是Cl元素,⑩号是Ar元素,(1)非金属性最强的是F元素,形成化合物种类最多的是C元素,答案为:F、C;(2)主族元素电子层数相同时,核电荷越多原子半径越小,所以第三周期元素除⑩外原子半径最小的是Cl元素,金属性越强,最高价氧化物对应水化物的碱性越强,金属性越强的是Na元素,所以碱性最强的是NaOH,具有两性的是Al(OH)3,答案为:Cl , NaOH , Al(OH)3;(3)Na、Mg、Al的活动性由强到弱的顺序为:Na>Mg>Al,答案为:Na>Mg>Al.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)2![]() 6H2O(M=392g
6H2O(M=392g![]() mol—1)又称莫尔盐,简称FAS,其俗名来源于德国化学家莫尔(Karl Friedrich Mohr)。它是浅蓝绿色结晶或粉末,对光敏感,在空气中会逐渐风化及氧化,可溶于水,几乎不溶于乙醇。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
mol—1)又称莫尔盐,简称FAS,其俗名来源于德国化学家莫尔(Karl Friedrich Mohr)。它是浅蓝绿色结晶或粉末,对光敏感,在空气中会逐渐风化及氧化,可溶于水,几乎不溶于乙醇。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
Ⅰ.莫尔盐的制取
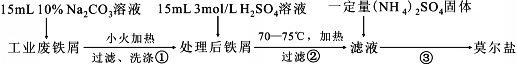
回答下列问题:
(1)步骤②必须在剩余少量铁屑时进行过滤,其原因是 。(用离子方程式表示)
(2)制取的莫尔盐最后要用 洗涤(填字母编号),其目的是: 。
a.蒸馏水 b.乙醇 c.滤液
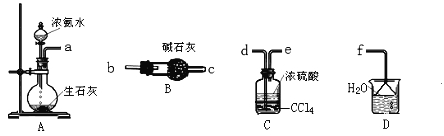
(3)从下图中选取必须用的仪器连接成实验室制取(NH4)2SO4溶液的装置,连接的顺序(用接口字母表示)是_____________。
Ⅱ.FAS纯度测定
为测定FAS纯度,取m g样品配制成500 mL溶液,根据物质组成,甲、乙两位同学设计了如下两个实验方案。
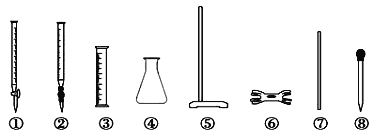
(1)甲方案:取20.00 mLFAS溶液,用0.1000 mol·L-1 的酸性K2Cr2O7 溶液进行滴定。
i)写出此反应的离子方程式: 。
ii) 滴定时必须选用的仪器是 。
(2)乙方案:取20.00 mLFAS溶液进行如下实验。
![]()
列出计算FAS晶体纯度的代数式 (不用计算出结果)。
(3)已知实验操作都正确,却发现甲方案的测定结果总是小于乙方案,其可能的原因是 ,设计简单的化学实验验证上述推测 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡
![]()
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
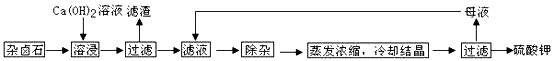
(1)滤渣主要成分有_______和_______以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
____ 。
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入_______溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高,
①________________________②_______________

(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
![]() 已知298K时,Ksp(CaCO3)
已知298K时,Ksp(CaCO3)
=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
(1)高温固相法是磷酸铁锂生产的主要方法。通常以铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛的保护中先经过较低温预分解,再经高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4═2NH3↑+3CO2↑+______+_______+_______
①完成上述化学方程式.
②理论上,反应中每转移0.15mol电子,会生成LiFePO4______________g;
③反应需在惰性气氛的保护中进行,其原因是______________;
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
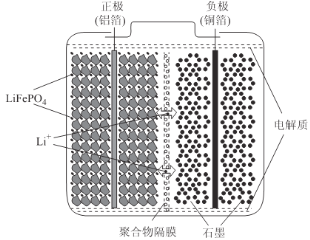
电池工作时的总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
(3)用该电池电解精炼铜。若用放电的电流强度I=2.0A的电池工作10分钟,电解精炼铜得到铜0.32g,则电流利用效率为______________(保留小数点后一位)。(已知:法拉第常数F=96500C/mol,电流利用效率=![]() 100%)
100%)
(4)废旧磷酸亚铁锂电池的正极材料中的LiFePO4难溶于水,可用H2SO4和H2O2的混合溶液浸取,发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
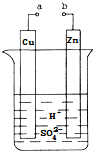
(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体(K3[Fe(C2O4) 3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml。
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、 、转移、洗涤并转移、 摇匀。
②加入锌粉的目的是 。
③写出步骤三中发生反应的离子方程式 。
④实验测得该晶体中铁的质量分数为 。在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量 。(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩锅中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误: ; 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应中,属于放热反应的是 ,属于吸热反应的是 。①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下)。导线中通过 mol电子。
(3)14CO2与碳在高温条件下发生反应:14CO2+C![]() 2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
2CO,该反应是 热反应,达到平衡后,平衡混合物中含14C的粒子有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂.用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的稀的路线如下:
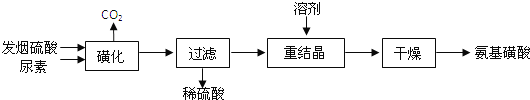
(1)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s)+SO3(g)![]() H2NCONHSO3H(s)△H<0
H2NCONHSO3H(s)△H<0
②H2NCONHSO3H+H2SO4![]() 2H2NSO3H+CO2↑
2H2NSO3H+CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是____________;
(2)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是____________;
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g 产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2molL-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000molL-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2.试求产品中氨基磺酸的质量分数。(请写出计算过程)
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有____________杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2SO2+ O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为
2SO3。反应达到平衡后,各物质的物质的量可能为
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 1.0 | 0 | 1.0 |
B | 0 | 0 | 2.0 |
C | 0.2 | 0.1 | 1.8 |
D | 1.5 | 0.75 | 1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com