
【题目】锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
(1)高温固相法是磷酸铁锂生产的主要方法。通常以铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛的保护中先经过较低温预分解,再经高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4═2NH3↑+3CO2↑+______+_______+_______
①完成上述化学方程式.
②理论上,反应中每转移0.15mol电子,会生成LiFePO4______________g;
③反应需在惰性气氛的保护中进行,其原因是______________;
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
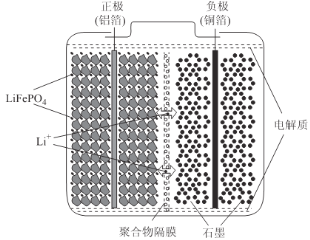
电池工作时的总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
(3)用该电池电解精炼铜。若用放电的电流强度I=2.0A的电池工作10分钟,电解精炼铜得到铜0.32g,则电流利用效率为______________(保留小数点后一位)。(已知:法拉第常数F=96500C/mol,电流利用效率=![]() 100%)
100%)
(4)废旧磷酸亚铁锂电池的正极材料中的LiFePO4难溶于水,可用H2SO4和H2O2的混合溶液浸取,发生反应的离子方程式为______________。
【答案】
(1)①2LiFePO4+2CO↑+5H2O↑
②23.7
③防止Fe(Ⅱ)被氧化
(2)Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
(3)80.4%
(4)2LiFePO4+2H++H2O2═2Li++2Fe3++2PO43-+2H2O
【解析】
试题分析:(1)①由原子守恒可知,Li2CO3+2FeC2O42H2O+2NH4H2PO4 ═2LiFePO4+2NH3↑+3CO2↑+2CO↑+7H2O↑;故答案为:2LiFePO4+2CO↑+5H2O↑;
②C2O42-中C的化合价为+3价,生成CO和CO2,C元素的化合价分别为+2价、+3价,生成2molCO转移2mol电子,同时生成2molLiFePO4,则当反应中每转移0.15mol电子,生成0.15molLiFePO4,其质量为23.7g;故答案为:23.7;
③亚铁离子容易被氧气氧化,所以要隔绝氧气,即反应需在惰性气氛的保护中进行;
故答案为:防止Fe(II)被氧化;
(2)电池工作时的总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,放电时,Li1-xFePO4在正极上得电子发生氧化反应,正极反应为Li1-xFePO4+xLi++xe-═LiFePO4;充电时,正极与外接电源的正极相连为阳极,阳离子向阴极移动,即Li+由左向右移动;电解质为锂盐,锂离子通过交换膜向正极移动,所以交换膜应该为阳离子交换膜;故答案为:Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
Li1-xFePO4+LixC6,放电时,Li1-xFePO4在正极上得电子发生氧化反应,正极反应为Li1-xFePO4+xLi++xe-═LiFePO4;充电时,正极与外接电源的正极相连为阳极,阳离子向阴极移动,即Li+由左向右移动;电解质为锂盐,锂离子通过交换膜向正极移动,所以交换膜应该为阳离子交换膜;故答案为:Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
(3)电解精炼铜得到铜0.32g时,即铜的物质的量为![]() =0.005mol,所以电解消耗的电量Q=2×0.005mol×96500C/mol,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量Q=It=2.0×10×60=1200C,所以电流利用效率=
=0.005mol,所以电解消耗的电量Q=2×0.005mol×96500C/mol,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量Q=It=2.0×10×60=1200C,所以电流利用效率=![]() ×100%=
×100%=![]() ×100%=80.4%,故答案为:80.4%
×100%=80.4%,故答案为:80.4%
(4)②LiFePO4中亚铁离子在酸性条件下,被双氧水氧化为铁离子,则发生反应的离子方程式为2LiFePO4+2H++H2O2═2Li++2Fe3++2PO43-+2H2O;故答案为:2LiFePO4+2H++H2O2 ═2Li++2Fe3++2PO43-+2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】阿立呱陛(A)是一种新的抗精神分裂症药物,可由化合物B、C、D在有机溶剂中通过以下两条路线合成得到。

(1) E的结构简式为 ,其含氧官能团有 (写名称)。
(2)由C, D生成化合物F的反应类型是 。化合物C与足量的NaOH乙醇溶液共热反应的产物的名称是 。
(3)H属于氨基酸,与B的水解产物互为同分异构体。H能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式: 、 。
(4)合成F(相对分子质量为366)时还可能生成一种相对分子质量为285的副产物G,G能使溴水褪色,G的结构简式为 。
(5)已知: 写出由C制备化合物
写出由C制备化合物
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑩十种元素,在元素周期表中的位置如图所示。回答下列问题:
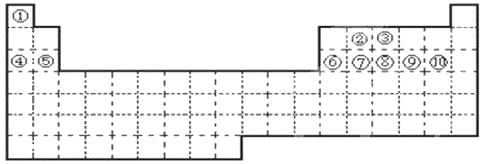
(1)在上述十种元素中,置换酸中氢的能力最强的元素为 (填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ;原子半径最大的元素是 ,半径最小的离子是 。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第 周期 族,该元素的单质在空气中燃烧的化学方程式为 。
(3)试用电子式表示元素①和③形成分子的过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。

则下列说法正确的是
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时,不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修2:化学与技术】硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂等。工业制取硝酸铵的工艺流程如下:
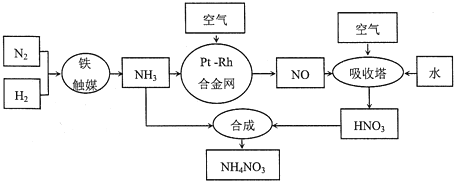
(1)合成氨气的工业设备名称_______________,设备中设置热交换器的目的是____________,合成氨的原料气必须先脱硫,目的是_______________;
(2)吸收塔中反应的化学方程式为_________________________,从生产流程看,吸收塔中需要补充空气,其原因是_______________;
(3)生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理:
方法一:碱性溶液吸收法
NO+NO2+2NaOH═2NaNO2+H2O;2NO2+Na2CO3═NaNO2+NaNO3+CO2
方法二:NH3还原法
8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H=-2635kJ/mol(NO也有类似的反应)
方法三:甲烷吸收法
CH4(g)+2NO2═CO2(g)+N2+2H2O(g)△H=+867kJ/mol(NO也有类似的反应)
上述三种方法中,方法一的主要缺点是_______________;
方法三和方法二相比,方法三的缺点是_______________;
(4)工业上也可以通过电解NO制备NH4NO3,其工作原理如图所示.
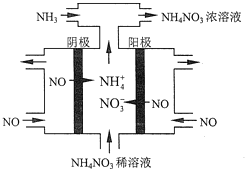
①图中通入NH3的目的是_______________;
②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为_____g;(已知F=96500Cmol-l)(保留2位有效数字).
(5)某化肥厂用NH3制备NH4NO3.己知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。

(2)己知下列热化学方程式:

由此可知反应:![]() 的焓变为 。
的焓变为 。
(3)在一固定体积的密闭容器中,进行如下化学反应
![]() 其化学平衡常数K与t的关系如下表:
其化学平衡常数K与t的关系如下表:

请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填写字母序号)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(正)(N2)=v(逆)(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
F.混合气体中各成分的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
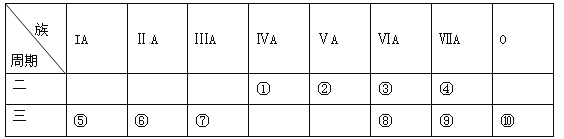
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是____________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______(填元素符号),判断的实验依据是_______(写出一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”、或“不”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”、或“不”)。
(2)O2 (g)=O+2(g)+e- ![]() H1=+ 1175.7 kJ·mol-1
H1=+ 1175.7 kJ·mol-1
PtF6(g)+ e- ![]() PtF6-(g)
PtF6-(g) ![]() H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g)=O2++PtF6- (s)的![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成___沉淀(填化学式),生成该沉淀的离子方程式为_________。(已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”、“碱”、或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
(1)As原子的核外电子排布式为 。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是 。
(3)NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角 (填“大”或“小”),原因是 。
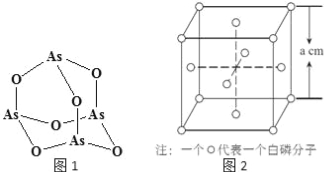
(4)Na3AsO4中含有的化学键类型包括 ;AsO43﹣的空间构型为 ,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 。
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是 晶体.
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).己知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l,则该晶胞中含有的P原子的个数为 ,该晶体的密度为 gcm﹣3(用含NA、a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com