
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��ͤ���о�С���������ҽ����������As2O3���׳���˪����Ѫ�������Ե��������ã�����N�����ף�P�����飨As���ȶ���VA���Ԫ�أ�����Ԫ�صĻ��������о�����������������Ҫ��;���ش��������⣺
��1��Asԭ�ӵĺ�������Ų�ʽΪ ��
��2��P��S��ͬһ���ڵ�����Ԫ�أ�P�ĵ�һ�����ܱ�S��ԭ���� ��
��3��NH4+��H��N��H�ļ��DZ�NH3��H��N��H�ļ��� �����С������ԭ���� ��
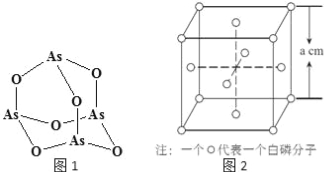
��4��Na3AsO4�к��еĻ�ѧ�����Ͱ��� ��AsO43���Ŀռ乹��Ϊ ��As4O6�ķ��ӽṹ��ͼ1��ʾ�����ڸû�������As���ӻ���ʽ�� ��
��5��������NH5�е�����ԭ������㶼�����ȶ��ṹ����NH5�� ���壮
��6�����ף�P4���ľ������ڷ��Ӿ��壬�侧���ṹ��ͼ2��СԲȦ��ʾ�����ӣ�����֪�����ı߳�Ϊa cm�������ӵ�����ΪNA mol��l����þ����к��е�Pԭ�ӵĸ���Ϊ ���þ�����ܶ�Ϊ gcm��3���ú�NA��a��ʽ�ӱ�ʾ����
���𰸡���1��1s22s22p63s23p63d104s24p3
��2��P��p�Dz��ǰ����״̬���Ƚ��ȶ������Ե�һ�����ܱ���Ĵ�
��3����NH4+�еĵ�ԭ���Ͼ�Ϊ�ɼ����ӣ���NH3�����еĵ�ԭ������һ�Թ¶Ե��ӣ��¶Ե��Ӻͳɼ�����֮����ų���ǿ�ڳɼ����Ӻͳɼ�����֮����ų���
��4�����Ӽ������ۼ����������壻sp3
��5������
��6��16��![]()
��������
�����������1��Asԭ�Ӻ��������Ϊ33�������������ԭ������������Ų�ʽΪ��1s22s22p63s23p63d104s24p3��
�ʴ�Ϊ��1s22s22p63s23p63d104s24p3��
��2��P��3p�Dz��ǰ����״̬���Ƚ��ȶ�����һ�����ܸ���ͬ��������Ԫ�صģ���һ�����ܴ�����ģ�
�ʴ�Ϊ��P��p�Dz��ǰ����״̬���Ƚ��ȶ������Ե�һ�����ܱ���Ĵ�
��3��NH4+�еĵ�ԭ���Ͼ�Ϊ�ɼ����ӣ���NH3�����еĵ�ԭ������һ�Թ¶Ե��ӣ��¶Ե��Ӻͳɼ�����֮����ų���ǿ�ڳɼ����Ӻͳɼ�����֮����ų�������NH4+��H-N-H�ļ��DZ�NH3��H-N-H�ļ��Ǵ�
�ʴ�Ϊ����NH4+�еĵ�ԭ���Ͼ�Ϊ�ɼ����ӣ���NH3�����еĵ�ԭ������һ�Թ¶Ե��ӣ��¶Ե��Ӻͳɼ�����֮����ų���ǿ�ڳɼ����Ӻͳɼ�����֮����ų�����
��4��Na3AsO4�������ӻ�����������Ӽ�����������к��й��ۼ���AsO43-��Asԭ�ӹµ��Ӷ���=![]() =0���۲���Ӷ���Ϊ4+0=4���ռ乹��Ϊ�������壻As4O6�ķ�����Asԭ���γ�3��As-O��������1�Թ¶Ե��ӣ��ӻ������ĿΪ4���ӻ�����Ϊsp3�ӻ���
=0���۲���Ӷ���Ϊ4+0=4���ռ乹��Ϊ�������壻As4O6�ķ�����Asԭ���γ�3��As-O��������1�Թ¶Ե��ӣ��ӻ������ĿΪ4���ӻ�����Ϊsp3�ӻ���
�ʴ�Ϊ�����Ӽ������ۼ����������壻sp3��
��5��������NH5�е�����ԭ������㶼�����ȶ��ṹ������笠��������⸺���ӹ��ɣ��������Ӿ��壬�ʴ�Ϊ�����ӣ�
��6�����ݾ�̯����֪��������P4������ĿΪ8��![]() +6��
+6��![]() =4������Pԭ����ĿΪ4��4=16����������Ϊ16��
=4������Pԭ����ĿΪ4��4=16����������Ϊ16��![]() g���������Ϊ��a cm��3�����ܶ�Ϊ
g���������Ϊ��a cm��3�����ܶ�Ϊ![]() =
=![]() g��cm-3��
g��cm-3��
�ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ӵ�ع㷺Ӧ�����ճ����Ӳ�Ʒ�У�Ҳ�ǵ綯����������ص���ѡ���������ϵ�ѡ�����������ӵ�ص����ܣ���������(LiFePO4)����߱����ԡ��߱���������ѭ�����ԡ��߰�ȫ�ԡ��ͳɱ����������ŵ����Ϊ����Դ��������
��1�����¹��෨�����������������Ҫ������ͨ�������Ρ������κ����Ϊԭ�ϣ�����ѧ�����ȳ�ֻ��Ⱥ��ڶ������յı������Ⱦ����ϵ���Ԥ�ֽ⣬�پ����±��գ���ĥ�����Ƴ����䷴Ӧԭ�����£�
Li2CO3+2FeC2O42H2O+2NH4H2PO4�T2NH3��+3CO2��+______+_______+_______
�����������ѧ����ʽ.
�������ϣ���Ӧ��ÿת��0.15mol���ӣ�������LiFePO4______________g��
����Ӧ���ڶ������յı����н��У���ԭ����______________��
��2����������﮵��װ����ͼ��ʾ�����������������ʯ��LiFePO4ͨ��ճ�ϼ��������������棬����ʯī���ϸ�����ͭ�����棬�����Ϊ�ܽ����л��ܼ��е������
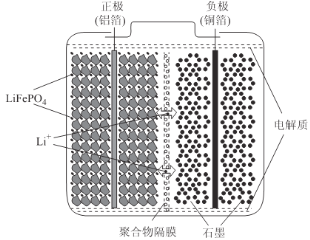
��ع���ʱ���ܷ�ӦΪ��LiFePO4+6C![]() Li1-xFePO4+LixC6����ŵ�ʱ�������ĵ缫��ӦʽΪ______________�����ʱ��Li+Ǩ�Ʒ���Ϊ______________(����������������������������)��ͼ�оۺ����ĤӦΪ______________(����������������)���ӽ���Ĥ��
Li1-xFePO4+LixC6����ŵ�ʱ�������ĵ缫��ӦʽΪ______________�����ʱ��Li+Ǩ�Ʒ���Ϊ______________(����������������������������)��ͼ�оۺ����ĤӦΪ______________(����������������)���ӽ���Ĥ��
��3���øõ�ص�⾫��ͭ�����÷ŵ�ĵ���ǿ��I=2.0A�ĵ�ع���10���ӣ���⾫��ͭ�õ�ͭ0.32g�����������Ч��Ϊ______________(����С�����һλ)��(��֪�������ڳ���F=96500C/mol����������Ч��=![]() 100%)
100%)
��4���Ͼ���������﮵�ص����������е�LiFePO4������ˮ������H2SO4��H2O2�Ļ����Һ��ȡ��������Ӧ�����ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������H2NSO3H����һԪ����ǿ�ᣬ����ˮ��Һ�����������Ҵ����ڹ�ҵ������������ϴ������ȼ�����ǻ�����������[CO��NH2��2]�ͷ�������������SO3��������Ϊԭ�Ϻϳɰ��������ϡ��·�����£�
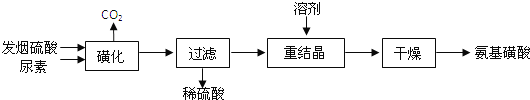
��1�����ǻ����������������ķ�ӦΪ��
��CO��NH2��2��s��+SO3��g��![]() H2NCONHSO3H��s����H��0
H2NCONHSO3H��s����H��0
��H2NCONHSO3H+H2SO4![]() 2H2NSO3H+CO2��
2H2NSO3H+CO2��
���ǻ�������Ӧ���Ʒ�Ӧ�¶�Ϊ75��80�������¶ȸ���80������������IJ��ʻή�ͣ�ԭ����____________��
��2���ؽᾧ��10%��12%���������ܼ�������ˮ���ܼ���ԭ����____________��
��3���ⶨ��Ʒ�а������ᴿ�ȵķ������£���ȡ7.920g ��Ʒ���l000mL����Һ����ȡ25.00mL����Һ����ƿ�У�����2mL 0.2molL-1ϡ���ᣬ�õ��۵⻯���Լ���ָʾ������μ���0.08000molL-1NaNO2��Һ������Һǡ�ñ���ʱ������NaNO2��Һ25.00mL����ʱ��������ǡ�ñ���ȫ������N2��NaNO2�Ļ�ԭ����ҲΪN2�������Ʒ�а����������������������д�����������
��4���Է�̪Ϊָʾ������NaOH��������к͵ζ�Ҳ�ܲⶨ��Ʒ�а�������Ĵ��ȣ��ⶨ���ͨ����NaNO2��ƫ�ߣ�ԭ���ǰ��������л���____________���ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25�� Ksp��Ag2S��=6.3��10��50��Ksp��AgCl��=1.5��10��16��ɳ����ѧij�о���ѧϰС��̽��
AgCl��Ag2S����ת����ԭ��
�� �� | �� �� |
��NaCl��AgNO3��Һ��� | ������ɫ���� |
�������ù�Һ������м�Na2S��Һ | ������Ϊ��ɫ |
���˳���ɫ����������NaCl��Һ | �ϳ�ʱ�������Ϊ���ɫ |
��1�����еİ�ɫ������ ��
��2��������˵��������ڵĵ����ӷ���ʽ�� ������ת������Ҫԭ���� ��
��3���˳�����������ɫ�������Ʋ⺬��AgCl����ŨHNO3�ܽ⣬��������ɫ���壬���ֳ���δ��
�⣬���˵õ���ҺX�Ͱ�ɫ����Y��
������X�еμ�Ba��NO3��2��Һ��������ɫ����
������Y�еμ�KI��Һ��������ɫ����
���ɢ��жϣ���ҺX�б������������ ��
���ɢ�������ȷ�ϲ���������ɫ��������AgCl����һ�ֳ���_____ _��
��4����ѧ��ͨ�����¶���ʵ��ȷ���˲������ ���ɫ����������ԭ����NaCl�����£����������к�ɫ����������

�� �� | B��һ��ʱ��������ɫ���� |
C��һ��ʱ��������Ա仯 |
��A�����������_________��
��C��ʢ�ŵ�����W��_________��
�۸�ͬѧ��ΪB�в��������ķ�Ӧ���£��벹����������
2Ag2S + ![]() +
+ ![]() + 2H2O
+ 2H2O ![]() 4AgCl +
4AgCl + ![]() + 4NaOH
+ 4NaOH
�ܴ�ƽ���ƶ��ĽǶȣ�����B��NaCl�����ã� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ȼ��֬�ķ���ʽΪC57H106O6��1mol����֬ˮ��ɵõ�1mol���͡�1mol֬����X��2molֱ������֬����Y�����ⶨX����Է�������Ϊ280��ԭ�Ӹ�����ΪC��H��O=9��16��1������˵���������
A��X�ķ���ʽΪC18H32O2
B��֬����Y�ܷ���ȡ����Ӧ
C��Y�Ľṹ��ʽ����ΪCH3CH=CH(CH2)14COOH
D��Y�Ľṹ��ʽΪCH3(CH2)16COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��SO2�����ʣ�����ͼ��ʾװ�ý���ʵ����

��1��װ��A��ʢ���������Ƶ�����������_____�����з�����Ӧ�Ļ�ѧ����ʽΪ_____��
��2��ʵ������У�װ��B��C�з���������ֱ���____________��______________����Щ����ֱ�˵��SO2���е�������____��__��װ��B�з�����Ӧ�����ӷ���ʽΪ__________��
��3�����װ��D��Ŀ����____________________________________________________��
��4��β��Ӧ��____________________��Һ���������Լ��Ļ�ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������м���2.0 mol SO2��1.0 mol O2��һ�������·������·�Ӧ2SO2+ O2![]() 2SO3����Ӧ�ﵽƽ������ʵ����ʵ�������Ϊ
2SO3����Ӧ�ﵽƽ������ʵ����ʵ�������Ϊ
n(SO2)��mol | n(O2)��mol | n(SO3)��mol | |
A | 1.0 | 0 | 1.0 |
B | 0 | 0 | 2.0 |
C | 0.2 | 0.1 | 1.8 |
D | 1.5 | 0.75 | 1.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��NΪ�����ڵĵ���������Ԫ�ء�����X��Zͬ���壬Y��Zͬ���ڣ�M��X��Y�Ȳ�ͬ���壬Ҳ��ͬ���ڡ�Xԭ�������������Ǻ�����Ӳ�����������Y������ϼ�������ͻ��ϼ۵Ĵ����͵���6��N�Ƕ���������Ԫ����ԭ�Ӱ뾶���ķǽ���Ԫ�ء�
��1��XԪ��λ��Ԫ�����ڱ���λ���ǵ� ���ڣ��� ��
��2����д�����з�Ӧ�����ӷ���ʽ��N����������������Һ��Ӧ��
��3��Y��Z��ȣ��ǽ����Խ�ǿ��Ԫ�ص�ԭ�ӽṹʾ��ͼΪ ������֤���ý��۵�ʵ���ǣ������ӷ���ʽ��ʾ�� ��
��4���뽫X��Z��M��NԪ��ԭ�Ӱ뾶�Ӵ�С���� ����Ԫ�ط��ű�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪700��ʱ��H2(g)+CO2(g)![]() H2O(g)+CO(g)�����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v(H2O)Ϊ0.025mol/(Lmin)�������жϲ���ȷ����( )
H2O(g)+CO(g)�����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v(H2O)Ϊ0.025mol/(Lmin)�������жϲ���ȷ����( )
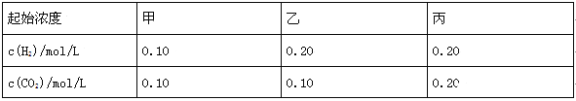
A��ƽ��ʱ������CO2��ת���ʴ���50%
B������Ӧƽ��ʱ������c(CO2)�Ǽ��е�2��
C���¶�����800����������Ӧƽ�ⳣ��Ϊ![]() ��������ӦΪ���ȷ�Ӧ
��������ӦΪ���ȷ�Ӧ
D�������������䣬����ʼʱ���������г���0.10mol/L H2��0.20 mol/L CO2������ƽ��ʱc (CO)��ԭ��������ƽ��ʱc (CO)��ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com