
【题目】氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂.用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的稀的路线如下:
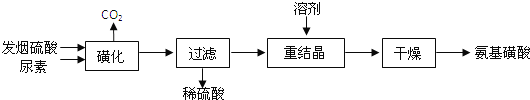
(1)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s)+SO3(g)![]() H2NCONHSO3H(s)△H<0
H2NCONHSO3H(s)△H<0
②H2NCONHSO3H+H2SO4![]() 2H2NSO3H+CO2↑
2H2NSO3H+CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是____________;
(2)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是____________;
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g 产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2molL-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000molL-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2.试求产品中氨基磺酸的质量分数。(请写出计算过程)
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有____________杂质。
【答案】
(1)温度高,SO3气体逸出加快,反应①平衡向逆反应方向移动,使反应①转化率降低;
(2)氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小;
(3)当溶液变蓝色时,说明H2NSO3H恰好完全反应,氨基磺酸和亚硝酸钠的反应方程式为:H2NSO3H+NaNO2=NaHSO4+N2↑+H2O,根据方程式知,n (H2NSO3H)=n(NaNO2)=25.00×l0-3×0.08000 molL-1=2.000×l0-3 mol;ω(H2NSO3H)=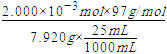 ×100%=98.0%;
×100%=98.0%;
(4)硫酸
【解析】
试题分析:(1)温度越高,三氧化硫气体逸出速率加快,且CO(NH2)2(s)+SO3(g)![]() H2NCONHSO3H(s)是放热反应,升高温度,平衡向逆反应方向移动,从而抑制氨基磺酸的产率,故答案为:温度高,SO3气体逸出加快,使反应①转化率降低.温度高,反应①平衡向逆反应方向移动;
H2NCONHSO3H(s)是放热反应,升高温度,平衡向逆反应方向移动,从而抑制氨基磺酸的产率,故答案为:温度高,SO3气体逸出加快,使反应①转化率降低.温度高,反应①平衡向逆反应方向移动;
(2)反应H2NCONHSO3H+H2SO4![]() 2H2NSO3H+CO2↑是可逆反应,硫酸浓度增大,平衡向正反应方向移动,所以能抑制氨基磺酸的溶解,故答案为:氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小;
2H2NSO3H+CO2↑是可逆反应,硫酸浓度增大,平衡向正反应方向移动,所以能抑制氨基磺酸的溶解,故答案为:氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小;
(3)当溶液变蓝色时,说明H2NSO3H恰好完全反应,氨基磺酸和亚硝酸钠的反应方程式为:H2NSO3H+NaNO2=NaHSO4+N2↑+H2O,根据方程式知,n (H2NSO3H)=n(NaNO2)=25.00×l0-3×0.08000 molL-1=2.000×l0-3 mol;
ω(H2NSO3H)=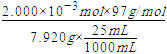 ×100%=98.0%,故答案为:98.0%;
×100%=98.0%,故答案为:98.0%;
(4)用氢氧化钠测定氨基磺酸的纯度,测定结果通常比NaNO2法偏高,说明还有其它物质和氢氧化钠反应,能和氢氧化钠反应的物质是硫酸,故答案为:硫酸。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】①~⑩十种元素,在元素周期表中的位置如图所示。回答下列问题:
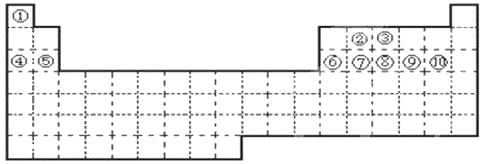
(1)在上述十种元素中,置换酸中氢的能力最强的元素为 (填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ;原子半径最大的元素是 ,半径最小的离子是 。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第 周期 族,该元素的单质在空气中燃烧的化学方程式为 。
(3)试用电子式表示元素①和③形成分子的过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
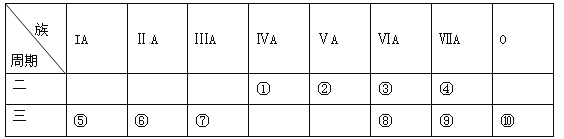
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是____________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______(填元素符号),判断的实验依据是_______(写出一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”、或“不”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”、或“不”)。
(2)O2 (g)=O+2(g)+e- ![]() H1=+ 1175.7 kJ·mol-1
H1=+ 1175.7 kJ·mol-1
PtF6(g)+ e- ![]() PtF6-(g)
PtF6-(g) ![]() H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g)=O2++PtF6- (s)的![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成___沉淀(填化学式),生成该沉淀的离子方程式为_________。(已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”、“碱”、或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色。
(1)写出基态Cu+的核外电子排布式____________;
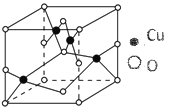
(2)如图结构是铜的某氧化物的晶体结构的最小重复单元,则该氧化物的化学式为____________;
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4H2O沉淀。
①该沉淀中S原子的杂化类型为____________;
②写出一种与NH3分子互为等电子体的阳离子的化学式____________。
(4)NH3的沸点高于PH3,原因是____________
(5)CuO的熔点比CuCl的熔点____________(填“高”或“低”),其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
2NO2(g)(红棕色)![]() N2O4(g)(无色),如图所示.
N2O4(g)(无色),如图所示.

(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4)
B.容器内压强不再发生变化
C.X的体积分数不再发生变化
D.容器内气体原子总数不再发生变化
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol的白磷(P4)或CCl4中所含的共价键数均为0.4NA
B.S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA
C.5.4gAl分别于含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA
D.在H2O2+Cl2=2HCl+O2反应中,每生成32gO2,转移4 NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
(1)As原子的核外电子排布式为 。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是 。
(3)NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角 (填“大”或“小”),原因是 。
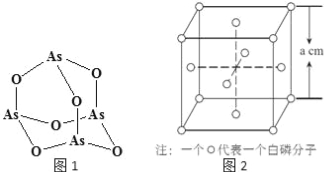
(4)Na3AsO4中含有的化学键类型包括 ;AsO43﹣的空间构型为 ,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 。
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是 晶体.
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).己知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l,则该晶胞中含有的P原子的个数为 ,该晶体的密度为 gcm﹣3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:

实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。 A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下”)
(6)反应温度应保持在90~95 ℃,其原因是
(7)本实验中,正丁醛的产率为 %。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com