
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:

实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。 A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下”)
(6)反应温度应保持在90~95 ℃,其原因是
(7)本实验中,正丁醛的产率为 %。
【答案】
(1)不能,易飞溅
(2)防止暴沸 冷却后补加
(3)分液漏斗 直形冷凝管
(4)C
(5)下
(6)既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(7)51
【解析】
试题分析:(1)因为浓硫酸的密度大,将Na2Cr2O7溶液加到浓硫酸中,容易发生迸溅,故答案为:不能,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加,故答案为:防止暴沸;冷却后补加;
(3)B仪器的名称是滴液漏斗,D仪器的名称直形冷凝管,故答案为:滴液漏斗;直形冷凝管;
(4)分液漏斗使用前必须进行的第一项操作是检漏,故答案为:C;
(5)正丁醛密度为0.8017 gcm-3,小于水的密度,故分层水层在下方,
故答案为:下;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=![]() =51%,
=51%,
故答案为:51。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂.用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的稀的路线如下:
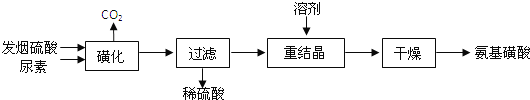
(1)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s)+SO3(g)![]() H2NCONHSO3H(s)△H<0
H2NCONHSO3H(s)△H<0
②H2NCONHSO3H+H2SO4![]() 2H2NSO3H+CO2↑
2H2NSO3H+CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是____________;
(2)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是____________;
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g 产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2molL-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000molL-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2.试求产品中氨基磺酸的质量分数。(请写出计算过程)
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有____________杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2SO2+ O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为
2SO3。反应达到平衡后,各物质的物质的量可能为
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 1.0 | 0 | 1.0 |
B | 0 | 0 | 2.0 |
C | 0.2 | 0.1 | 1.8 |
D | 1.5 | 0.75 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N为短周期的第五种主族元素。其中X、Z同主族,Y、Z同周期,M与X、Y既不同主族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)X元素位于元素周期表的位置是第 周期,第 族
(2)请写出下列反应的离子方程式:N单质与氢氧化钠溶液反应:
(3)Y与Z相比,非金属性较强的元素的原子结构示意图为 ,可以证明该结论的实验是(用离子方程式表示) 。
(4)请将X、Z、M、N元素原子半径从大到小排序: (用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol—1,则反应:NO2(g)+SO2(g)
2NO2(g) ΔH=-113.0 kJ·mol—1,则反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH= kJ·mol—1
SO3(g)+NO(g)的ΔH= kJ·mol—1
(2)利用反应6NO2+ 8NH3 ![]() 7N2+12H2O可处理NO2。一定条件下,将该反应设计成如右图所示装置,其中电极均为石墨,使用熔融金属氧化物作电解质,写出负极电极反应式 ;若一段时间内测得外电路中有1.2mol电子通过,则两极共产生的气体产物在标准状况下的体积为 L。
7N2+12H2O可处理NO2。一定条件下,将该反应设计成如右图所示装置,其中电极均为石墨,使用熔融金属氧化物作电解质,写出负极电极反应式 ;若一段时间内测得外电路中有1.2mol电子通过,则两极共产生的气体产物在标准状况下的体积为 L。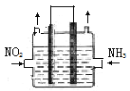
(3)一定条件下,将NO2与SO2以体积比1︰2置于恒容密闭容器中发生下述反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g),下列能说明该反应达到平衡状态的是 。
SO3(g)+NO(g),下列能说明该反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的物质的量比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
(4)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)。一定温度下,向容积为2L的密闭容器中充入2molCO和2molH2发生上述反应,5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,计算反应开始至平衡时的平均速率v(H2)= ;该温度下反应的平衡常数为 (保留两位小数)。
CH3OH(g)。一定温度下,向容积为2L的密闭容器中充入2molCO和2molH2发生上述反应,5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,计算反应开始至平衡时的平均速率v(H2)= ;该温度下反应的平衡常数为 (保留两位小数)。
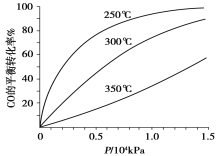
(5)不同温度CO的平衡转化率与压强的关系如上图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知某烷烃分子中电子数为42。
(1)该烷烃的分子式为________________________。
(2)写出该烷烃分子的所有同分异构体的结构简式:_________________________。
(3)上述同分异构体中,在相同条件下沸点最低的是____________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
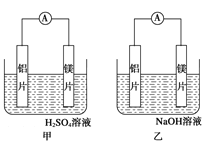
(1)写出甲中正极的电极反应式_____________________________。
(2)写出乙电池中总反应的离子方程式: ___________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________(填写元素符号,下同)的金属活动性更强,而乙会判断出________的金属活动性更强。
(4)由此实验,可得到如下哪些正确结论
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属活动性不一定比铝的金属活动性强
C.该实验说明金属活动性顺序表已过时,已没有使用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正、负极”这种做法_________(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正、负极的可行实验___________ (如可靠,可不填写)。
(6)将5.1g镁铝合金溶于60mL 5.0 mol·L-1H2SO4溶液中,完全溶解后再加入65mL 10.0mol·L-1的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
①当加入 mL NaOH溶液时,可使溶解在硫酸的Mg2+和Al3+恰好完全沉淀。
②合金溶于硫酸时所产生的氢气在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断不正确的是( )
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断不正确的是( )
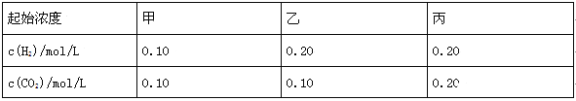
A.平衡时,乙中CO2的转化率大于50%
B.当反应平衡时,丙中c(CO2)是甲中的2倍
C.温度升至800℃,上述反应平衡常数为![]() ,则正反应为吸热反应
,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与原容器乙达平衡时c (CO)不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案_____________________;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为_________kJ;
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
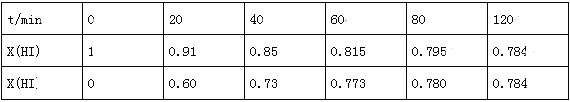
①根据上述实验结果,该反应的平衡常数K的计算式为:______________;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向_______(填“正”或“逆”)反应方向移动,达到平衡后x(HI)_______(填“增大”、“减小”或“不变”)。
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为_______(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=________min-1.
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为__________(填字母)。

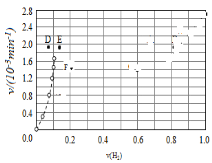
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com