
����Ŀ���мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾���þƬ����Ƭ���缫������ͬѧ���缫����6 mol��L��1��H2SO4��Һ�У���ͬѧ���缫����6 mol��L��1��NaOH��Һ�У���ͼ��ʾ��
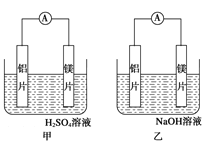
��1��д�����������ĵ缫��Ӧʽ_____________________________��
��2��д����������ܷ�Ӧ�����ӷ���ʽ�� ___________________��
��3�����������ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ������ɸ������ϵĽ���Ӧ�ȹ����������ϵĽ������á�������жϳ�________����дԪ�ط��ţ���ͬ���Ľ��������ǿ�����һ��жϳ�________�Ľ�����Ը�ǿ��
��4���ɴ�ʵ����������������Щ��ȷ����
A������ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
B��þ�Ľ�����Բ�һ�������Ľ������ǿ
C����ʵ��˵���������˳����ѹ�ʱ����û��ʹ�ü�ֵ
D����ʵ��˵����ѧ�о������ӡ���Ӧ������Ӱ��ϴ����Ӧ��������������
��5������ʵ��Ҳ������֤���ˡ�ֱ�����ý������˳���ж�ԭ����е�������������������_________(��ɿ������ɿ���)���粻�ɿ������������һ���ж�ԭ������������Ŀ���ʵ��___________ (��ɿ����ɲ���д)��
��6����5.1gþ���Ͻ�����60mL 5.0 mol��L��1H2SO4��Һ�У���ȫ�ܽ���ټ���65mL 10.0mol��L��1��NaOH��Һ���õ�����������Ϊ9.7g�������μ�NaOH��Һʱ��������١�
�������� mL NaOH��Һʱ����ʹ�ܽ��������Mg2+��Al3+ǡ����ȫ������
���Ͻ���������ʱ�������������ڱ�״���µ����Ϊ L��
���𰸡�
��1�� 2H����2e��=H2����
��2�� 2Al��2OH-��2H2O=2AlO2-��3H2����
��3�� Mg�� Al������4�� AD��
��5�� ���ɿ����������������õ��ߴ����������ϣ�ͨ����������ָ��ƫת�жϵ���������������������
��6�� 60�� 5.6��
��������
�����������1������þ��ʧ������������Al��������������þ����������Ӧ�������������ӷ�����ԭ��Ӧ��������ӦΪMg-2e- =Mg2+��������ӦΪ2H����2e��=H2������2���ҳ�������ʧ��������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��Al+4OH- -3e- =AlO2 - +2H2O��þ������������������ԭ��Ӧ���ܷ�ӦΪ2Al��2OH-��2H2O=2AlO2-��3H2������3������þ���������������������������������Ľ���������ǿ�жϣ�����þ���ǿ�����������ǿ����4��A�����ݼס����е缫��Ӧʽ֪��ԭ�����������������Һ�йأ���ȷ��B.þ�Ľ����Դ���������ʧ�������׳̶���������Һ�йأ�����C.��ʵ��˵���������Һ����Ӱ��缫��������������˵���������˳��û��ʹ�ü�ֵ������D.��ʵ��˵����ѧ�о������ӣ���Ӧ�������йأ��缫������ͬ�䷴Ӧ������ͬ��������ﲻͬ������Ӧ������������������ȷ����5������ʵ��Ҳ������֤���ˡ�ֱ�����ý������˳���ж�ԭ����е����������������������ɿ����粻�ɿ�����һ���ж�ԭ������������Ŀ���ʵ���ǽ������������õ��ߴ����������ϣ�ͨ����������ָ��ƫת�жϵ�����������������������6���������ķ�ӦΪ��Mg+ H2SO4=MgSO4 +H2����2Al+3H2SO4=Al2 (SO4 )3 +3H2����MgSO4 +2NaOH=Mg(OH)2��+Na2SO4 ��Al2 (SO4 )3 +6NaOH =2Al(OH)3��+3Na2SO4�� ��n(H2SO4)=0.06L��5mol/L=0.3mol���������е�Mg2+��Al3+ǡ����ȫ����ʱ����Һ�ɷ�ΪNa2SO4����ʱn(NaOH)=2n(H2SO4)=2��0.3mol=0.6mol������V(NaOH)= 0.6mol��10mol/L =0.06L=60ml����������60mlNaOH��Һʱ��þ���ӡ�������ǡ�ó�����������n(NaOH)= 0.065L�� 10mol/L=0.65molʱ��NaOH������n(NaOH)(����)=0.65mol-0.6mol=0.05mol��������Al(OH)3+NaOH =NaAlO2 +2H2O�����ܽ��n[Al(OH)3]=0.05mol��m(Al(OH)3)=0.05mol��78g/mol=3.9g�����������е�Mg��Alǡ����ȫ����������ӦΪ3.9g+9.7g=13.6g���������к���xmolMg��ymolAl����24x+27y��5.1g��58x+78y��13.6g����֮�ã�x=0.1��y=0.1�����Ը��ݵ����غ�ɵ÷�Ӧ�������������ʵ�����n(H2)=x+3/2y=0.1mol+0.15mol=0.25mol��V(H2)=0.25mol��22.4L/mol=5.6L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA Ϊ�����ӵ�������ֵ������˵����ȷ����
A��0.1mol�İ���(P4)��CCl4�������Ĺ��ۼ�����Ϊ0.4NA
B��S2��S8�Ļ���ﹲ6.4g�����������ĵ�����һ��Ϊ3.2NA
C��5.4gAl�ֱ��ں�����0.2mol��NaOH��Һ�����ᷴӦ������H2��������Ϊ0.3NA
D����H2O2+Cl2=2HCl+O2��Ӧ�У�ÿ����32gO2��ת��4 NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
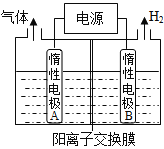
����Ŀ������LiOH������������Ʊ�����ӵ���������ϡ�LiOH���ɵ�ⷨ�Ʊ���������ͼװ�õ���Ʊ�LiOH�����缫�����Һ�ֱ�ΪLiOH��LiCl��Һ��B�������ҺΪ ��Һ(�ѧʽ)�������缫��ӦʽΪ ����������Li+�� �缫Ǩ��(����A������B��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȩ��һ�ֻ���ԭ�ϡ�ijʵ��С����������װ�úϳ�����ȩ��

�����ķ�Ӧ������CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
��Ӧ��Ͳ������������б�������

ʵ�鲽��������
��6.0 g Na2Cr2O7����100 mL�ձ�������30 mLˮ�ܽ����ٻ�������5 mLŨ��������������ҺС��ת����B�С���A�м���4.0 g�������ͼ�����ʯ�����ȡ�������������ʱ����ʼ�μ�B����Һ���μӹ����б��ַ�Ӧ�¶�Ϊ90-95 ������E���ռ�90 �����µ���֡�������ﵹ���Һ©��������ȥˮ�����л��������������ռ�75-77 �����������2.0 g��
�ش�����������
��1��ʵ�������ܷ�Na2Cr2O7��Һ�ӵ�Ũ��������˵������ ��
��2�������ʯ�������� �������Ⱥ���δ�ӷ�ʯ��Ӧ��ȡ����ȷ������ ��
��3������װ��ͼ����B������������ ��D������������ ��
��4����Һ©��ʹ��ǰ������еIJ����� (����ȷ�𰸱��)�� A����ʪ B������ C����© D���궨
��5��������ȩ�ֲ�Ʒ���ڷ�Һ©���з�ˮʱ��ˮ�� ��(����������������)
��6����Ӧ�¶�Ӧ������90~95 ������ԭ����
��7����ʵ����������ȩ�IJ���Ϊ %��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʳ��ά����ͻ���ı������ܣ��������������Ӫ��������ľ������һ�ַ�������ʳ��ά���䵥��֮һ---���Ӵ��ṹ��ʽ����ͼ��ʾ�������йؽ��Ӵ���˵����ȷ����( )
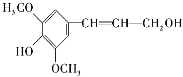
A�����Ӵ������������ֹ�����
B�����Ӵ�����������̼ԭ�Ӳ�������ͬһƽ����
C��1mol���Ӵ�������Ũ��ˮ��Ӧ���������3molBr2
D�����Ӵ��ܷ����ķ�Ӧ������������ȡ�����ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A���緢������ţ���У������������Ǵ�л���м��壬�����������������۵ȷ����Ƶá�A�ĸ���������ϲ���IJ��Ƽ�֮һ��A��ij�ִ��������½�������������ﲻ�ܷ���������Ӧ����Ũ��������£�A�ɷ�������ͼ��ʾ�ķ�Ӧ��

��1����д��������Ľṹ��ʽ��A_____________��E_____________��F_____________��
��2����ѧ����ʽ��A��B:______________________________________��
��3���ĸ���Ӧ�У�������������Ӧ���ǣ�A��_________(������Ӧ����ĸ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᶼ����Ҫ�Ļ�ѧƷ��
��1���������������������ϳ��������Ӧԭ������ͼ����Ҫ��ע���Լ�����Ӧ������
��ʾ����![]() ��
��
��2�����Ȼ��ƺ�Ũ��ˮ�Ļ����Һ��ͨ�����CO2�Ӷ�����NaHCO3���壬�Ǻ����Ƽ�Ĺؼ����裬��һ����ѧ����ʽ��ʾ�÷�Ӧԭ�� ����0.1 mol/L��ϡ��ˮ�У�����ʽ�ӳ������� ��
A��c(NH3��H2O) + c(NH3) + c(NH4+) = 0.1 mol/L
B��c(NH3��H2O) > c(NH3) + c(NH4+)
C��c(H+) > c(OH-)
D��c(NH4+) + c(H+) = c(OH-)
��3��A����ѧ��ѧ�������壬��װ��A�ļ���ƿ��ƿ�ڳ��ְ�������A�백����ϣ��������ִ������̣���������B����A�ķ���ʽΪ ������B�������Ļ�ѧ�������� ��
��4����6.4 gͭ��Ͷ��һ������Ũ�����У�ͭ��ȫ�ܽ⣬������״���µĻ������3.36 L���������ֳɷ�����������Ϊ ����Ӧ���ܹ����ĵ����� mol��
��5����4 mol HNO3��ϡ��Һ�У������������������������ɵ�����ֻ��һ�֣���������ϵ�л���n(����)��n(Fe)�仯��ʾ��ͼ�������n(����)�����ֵ��
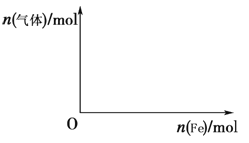
��6�����������������ĵ�����������Ȼ���ײ�����ֽ⣬���ֽ�ʱֻ�������������д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������У���ij��̼ԭ���������ĸ���ͬ��ԭ�ӻ�ԭ����ʱ������̼ԭ�ӳ�Ϊ������̼ԭ���������磬��ͼ�л�������д���*��̼ԭ�Ӿ�������̼ԭ�ӡ����л���ֱ������з�Ӧ�����ɵ��л���������Ժ�������̼ԭ�ӵ�( )
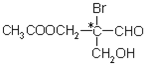
A. �����ᷢ��������Ӧ
B. ��NaOHˮ��Һ��Ӧ
C. ��������Һ����ֻ����������Ӧ
D. ������������H2��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ���ʼܹ������ʵ���Ҫ���ߡ������Ԫ���١��������ڱ��е�λ�ã��ش��������⣺

��1��Ԫ������Ԫ�����ڱ���λ��Ϊ____________��
��2����ԭ�Ӹ�����Ϊ1��1��1������������ ����Ԫ����ɹ��ۻ�����X�����γ�4�Թ��õ��Ӷԣ�X�ĽṹʽΪ ��
��3�������������������������������Ӧ��ˮ��������Һ�н��еĵ����ӷ�Ӧ����ʽ ��
��4���ɱ�������Ԫ�ص�ԭ�Ӱ�1:1��ɵ����ӻ����ﳣ�������������û������еĻ�ѧ������Ϊ ��
��5��A��B��D��E������������Ԫ����ɵĻ��������֮���ת����ϵ��ͼ��ʾ�����ֲ�������ȥ����A��B��D����ɫ��Ӧ���ʻ�ɫ��ˮ��Һ��Ϊ���ԡ���ش�
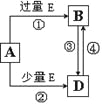
��E�ĵ���ʽΪ ��
����Ȼ���д���B��D��H2O��һ�������ᾧ���ɵĹ��塣ȡһ�����ù�������ˮ���100 mL��Һ�������Һ�н��������ӵ�Ũ��Ϊ0.5 mol/L����ȡ��ͬ�����Ĺ���������������ٷ����仯��ʣ����������Ϊ g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com