
【题目】X、Y、Z、M、N为短周期的第五种主族元素。其中X、Z同主族,Y、Z同周期,M与X、Y既不同主族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)X元素位于元素周期表的位置是第 周期,第 族
(2)请写出下列反应的离子方程式:N单质与氢氧化钠溶液反应:
(3)Y与Z相比,非金属性较强的元素的原子结构示意图为 ,可以证明该结论的实验是(用离子方程式表示) 。
(4)请将X、Z、M、N元素原子半径从大到小排序: (用元素符号表示)
【答案】(1)X是第2周期,第VIA族;
(2)Si+2OH-+H2O=SiO32-+2H2↑;
(3)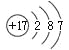 ;Cl2+S2-=2Cl-+S↓;
;Cl2+S2-=2Cl-+S↓;
(4)Si>S>O>H(硅>硫>氧>氢)。
【解析】试题分析:X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素。(1)X元素是O元素,位于元素周期表的位置是第2周期,第VIA族;(2)Si可以与NaOH溶液发生反应,产生Na2SiO3和氢气,反应的离子方程式是:Si+2OH-+H2O=SiO32-+2H2↑;(3) Y是Cl,Z是 S,二者是同一周期的元素,元素的非金属性Cl>S,则较强的元素的原子结构示意图为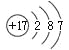 ,活动性强的可以把活动性弱的从化合物中置换出来,可以证明该结论的实验是Cl2+S2-=2Cl-+S↓。(4)同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径就越大,所以X、Z、M、N元素原子半径从大到小排序是Si>S>O>H。
,活动性强的可以把活动性弱的从化合物中置换出来,可以证明该结论的实验是Cl2+S2-=2Cl-+S↓。(4)同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径就越大,所以X、Z、M、N元素原子半径从大到小排序是Si>S>O>H。


科目:高中化学 来源: 题型:
【题目】化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”、或“不”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”、或“不”)。
(2)O2 (g)=O+2(g)+e- ![]() H1=+ 1175.7 kJ·mol-1
H1=+ 1175.7 kJ·mol-1
PtF6(g)+ e- ![]() PtF6-(g)
PtF6-(g) ![]() H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g)=O2++PtF6- (s)的![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成___沉淀(填化学式),生成该沉淀的离子方程式为_________。(已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”、“碱”、或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
(1)As原子的核外电子排布式为 。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是 。
(3)NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角 (填“大”或“小”),原因是 。
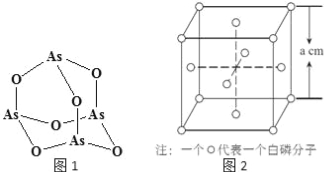
(4)Na3AsO4中含有的化学键类型包括 ;AsO43﹣的空间构型为 ,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 。
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是 晶体.
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).己知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l,则该晶胞中含有的P原子的个数为 ,该晶体的密度为 gcm﹣3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
苯酚是一种重要的化工原料。以苯酚为主要起始原料,某种药物中间体的合成路线如下:

已知:![]()
(1)C中含氧官能团的名称为 ;
(2)反应I的反应类型是 ;
(3)反应Ⅱ的化学方程式为 ;
(4)化合物B的名称是 ,E的结构简式为 ;
(5)写出满足下列条件的F的同分异构体的结构简式 (任写两种)。
![]() ①苯环上有三个取代基且苯环上的一氯取代物只有两种.②能与FeCl3溶液发生显色反应.③红外光谱显示有
①苯环上有三个取代基且苯环上的一氯取代物只有两种.②能与FeCl3溶液发生显色反应.③红外光谱显示有
查看答案和解析>>
科目:高中化学 来源: 题型:
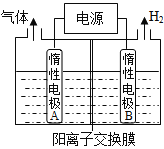
【题目】利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质.B与冷水缓慢反应,与沸水迅速反应,放出氢气.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱.C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀.

请回答下列问题:
(1)组成B单质的元素在周期表第 周期第 族 .化合物C的电子式为 .
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出D与足量的N反应生成E和F的化学方程式;
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有 个.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:

实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。 A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下”)
(6)反应温度应保持在90~95 ℃,其原因是
(7)本实验中,正丁醛的产率为 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应:

(1)试写出化合物的结构简式:A_____________,E_____________,F_____________。
(2)化学方程式:A→B:______________________________________,
(3)四个反应中,不属于酯化反应的是:A→_________(填化合物对应的字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期原子序数依次递增的五种元素A、B、C、D、E。 A、D元素基态原子中成对电子数是未成对电子数的3倍,且D元素基态原子中有6个未成对电子;B的基态原子核外只有7个原子轨道填充了电子,B、C元素基态原子的3p能级上均有1个未成对电子;E元素排在周期表的15列。
(1)B元素基态原子核外电子有_______种运动状态,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_______、电子数为_____。
(2)C、E两元素可以形成化合物EC3,此化合物的VSEPR模型为_______,是_______分子(填“极性”、“非极性”)。
(3)写出D基态原子的外围电子排布图____________。
(4)B、C两元素也可以形成共价化合物BC3,但BC3经常以二聚(B2C6)的形式存在,二聚分子具有配位键,分子中原子间成键的关系如下图所示.请将图中,你认为是配位键的斜线上加上箭头。
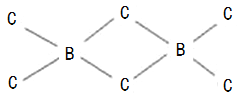
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com