
【题目】某天然油脂的分子式为C57H106O6。1mol该油脂水解可得到1mol甘油、1mol脂肪酸X和2mol直链饱和脂肪酸Y;经测定X的相对分子质量为280,原子个数比为C:H:O=9:16:1。下列说法错误的是
A.X的分子式为C18H32O2
B.脂肪酸Y能发生取代反应
C.Y的结构简式可能为CH3CH=CH(CH2)14COOH
D.Y的结构简式为CH3(CH2)16COOH
【答案】C
【解析】
试题分析:X的相对分子质量为280,原子个数比为C:H:O=9:16:1,设B的分子式为C9nH16nOn,n=![]() =2,所以X的分子式为:C18H32O2;油脂的水解可以表示成:C57H106O6+3H2O→C3H8O3(甘油)+C18H32O2+2Y,根据原子守恒知,Y的分子式为:C18H36O2,结合Y是直链脂肪酸,可知Y的结构简式为:CH3-(CH2)16-COOH,为硬脂酸;A.X的分子式为C18H32O2,故A正确;B.脂肪酸Y能与醇发生酯化反应,属于取代反应,故B正确;C.Y的结构简式可为CH3(CH2)16COOH,不含有碳碳双键,故C错误;D.Y的结构简式为CH3(CH2)16COOH,故D正确,答案为C。
=2,所以X的分子式为:C18H32O2;油脂的水解可以表示成:C57H106O6+3H2O→C3H8O3(甘油)+C18H32O2+2Y,根据原子守恒知,Y的分子式为:C18H36O2,结合Y是直链脂肪酸,可知Y的结构简式为:CH3-(CH2)16-COOH,为硬脂酸;A.X的分子式为C18H32O2,故A正确;B.脂肪酸Y能与醇发生酯化反应,属于取代反应,故B正确;C.Y的结构简式可为CH3(CH2)16COOH,不含有碳碳双键,故C错误;D.Y的结构简式为CH3(CH2)16COOH,故D正确,答案为C。


科目:高中化学 来源: 题型:
【题目】【化学选修2:化学与技术】硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂等。工业制取硝酸铵的工艺流程如下:
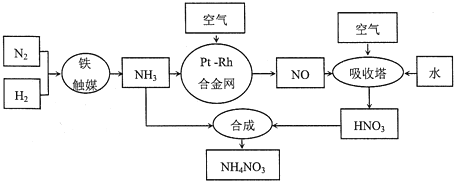
(1)合成氨气的工业设备名称_______________,设备中设置热交换器的目的是____________,合成氨的原料气必须先脱硫,目的是_______________;
(2)吸收塔中反应的化学方程式为_________________________,从生产流程看,吸收塔中需要补充空气,其原因是_______________;
(3)生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理:
方法一:碱性溶液吸收法
NO+NO2+2NaOH═2NaNO2+H2O;2NO2+Na2CO3═NaNO2+NaNO3+CO2
方法二:NH3还原法
8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H=-2635kJ/mol(NO也有类似的反应)
方法三:甲烷吸收法
CH4(g)+2NO2═CO2(g)+N2+2H2O(g)△H=+867kJ/mol(NO也有类似的反应)
上述三种方法中,方法一的主要缺点是_______________;
方法三和方法二相比,方法三的缺点是_______________;
(4)工业上也可以通过电解NO制备NH4NO3,其工作原理如图所示.
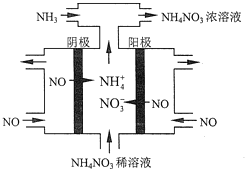
①图中通入NH3的目的是_______________;
②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为_____g;(已知F=96500Cmol-l)(保留2位有效数字).
(5)某化肥厂用NH3制备NH4NO3.己知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色。
(1)写出基态Cu+的核外电子排布式____________;
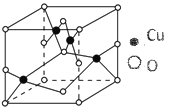
(2)如图结构是铜的某氧化物的晶体结构的最小重复单元,则该氧化物的化学式为____________;
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4H2O沉淀。
①该沉淀中S原子的杂化类型为____________;
②写出一种与NH3分子互为等电子体的阳离子的化学式____________。
(4)NH3的沸点高于PH3,原因是____________
(5)CuO的熔点比CuCl的熔点____________(填“高”或“低”),其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol的白磷(P4)或CCl4中所含的共价键数均为0.4NA
B.S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA
C.5.4gAl分别于含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA
D.在H2O2+Cl2=2HCl+O2反应中,每生成32gO2,转移4 NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
(1)As原子的核外电子排布式为 。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是 。
(3)NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角 (填“大”或“小”),原因是 。
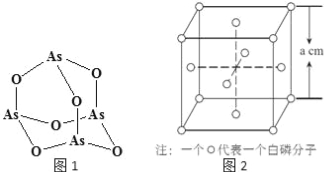
(4)Na3AsO4中含有的化学键类型包括 ;AsO43﹣的空间构型为 ,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 。
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是 晶体.
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).己知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l,则该晶胞中含有的P原子的个数为 ,该晶体的密度为 gcm﹣3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
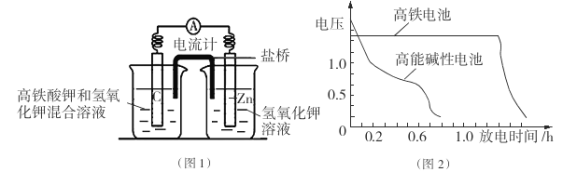
(1)该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作10 min ,理论消耗Zn g(已知F=96500 C/mol)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有 。
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
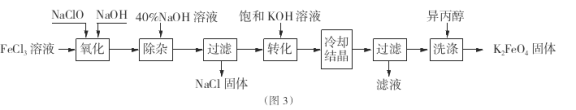
(4)完成“氧化”过程中反应的化学方程式:
![]()
其中氧化剂是 (填化学式)。
(5)加入饱和KOH溶液的目的是
(6)已知25℃时Ksp[Fe(OH)3]=4.0×![]() ,此温度下若在实验室中配制5mol/L
,此温度下若在实验室中配制5mol/L
l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
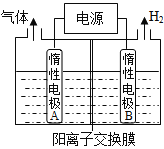
【题目】利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的化学品。
(1)画出采用氨催化氧化法合成硝酸的反应原理流程图:(要求注明试剂、反应条件)
(示例:![]() )
)
(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,是侯氏制碱法的关键步骤,用一个化学方程式表示该反应原理 。在0.1 mol/L的稀氨水中,下列式子成立的是 。
A.c(NH3·H2O) + c(NH3) + c(NH4+) = 0.1 mol/L
B.c(NH3·H2O) > c(NH3) + c(NH4+)
C.c(H+) > c(OH-)
D.c(NH4+) + c(H+) = c(OH-)
(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟,生成物质B,则A的分子式为 ,物质B中所含的化学键类型有 。
(4)将6.4 g铜粉投入一定量的浓硝酸中,铜完全溶解,产生标准状况下的混合气体3.36 L,其中两种成分气体的体积比为 ,反应中总共消耗的硝酸 mol。
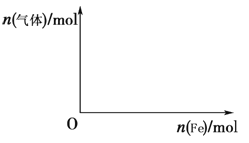
(5)向含4 mol HNO3的稀溶液中,逐渐加入铁粉至过量。假设生成的气体只有一种,请在坐标系中画出n(气体)随n(Fe)变化的示意图,并标出n(气体)的最大值。
(6)氨气和硝酸生产的氮肥硝酸铵受热或受撞击容易分解,若分解时只生成两种氧化物,写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com