
����Ŀ���������������չ�ҵ�����ķ���CO2��NO2��SO2 �ȿ��Լ�����Ⱦ�����Ϊ����
��1����CO2��������ȼ�ϼ״���
��֪��CO2��g��+3H2��g���TCH3OH��g��+H2O��l����H=��akJmol��1��
2H2��g��+O2��g���T2H2O��l����H=��b kJmol��1��
���ʾCH3OH��g��ȼ�յ��Ȼ�ѧ����ʽΪ��_______________________��
��2��������COCl2������Ҫ����ԭ�ϣ������ھ�������ϵ���������ҵͨ��Cl2��g��+CO��g��COCl2��g����H < 0�Ʊ���ͼΪʵ���о������������ڸ����ʵ�Ũ����ʱ��仯�����ߡ��ش��������⣺

��0��6min�ڣ���Ӧ��ƽ������v��Cl2��=___________��
�ڸ÷�Ӧ��һ�δ�ƽ��ʱ��ƽ�ⳣ��Ϊ___________��10min�ı��������_____________��
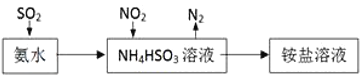
��3�����ð�ˮ���Խ�SO2��NO2���գ�ԭ����ͼ��ʾ��NO2�����յ����ӷ���ʽ��________________________________��
��4������2NO(g)��2CO(g)![]() N2(g)��2CO2(g)����1 L�ĺ����ܱ������н��з�Ӧ��������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����________(����ĸ����)��
N2(g)��2CO2(g)����1 L�ĺ����ܱ������н��з�Ӧ��������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����________(����ĸ����)��
A��c(CO)��c(CO2) B�������л��������ܶȲ���
C��2v(N2)����v(NO)�� D�������л�������ƽ��Ħ����������
���𰸡�2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ��H = +(2a-3b)kJ��mol-10.15 mol��L-1��min-130�����¶�2NO2+4HSO3- =N2+4SO42-+4H+CD
��������
(1)��CO2(g)+3H2(g)�TCH3OH(g)+H2O(l) ��H=-akJmol-1����2H2(g)+O2(g)�T2H2O(l) ��H=-bkJmol-1�����ø�˹���ɼ������3-����2�õ���ʾCH3OH(g)ȼ�յ��Ȼ�ѧ����ʽ��2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ��H=+(2a-3b)kJmol-1 ���ʴ�Ϊ��2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ��H=+(2a-3b)kJmol-1��
(2)����ͼ��֪��6minʱCl2��ƽ��Ũ��Ϊ0.3mol/L��Ũ�ȱ仯Ϊ1.2mol/L-0.3mol/L=0.9mol/L����v(Cl2)=![]() =0.15 molL-1min -1���ʴ�Ϊ��0.15molL-1min-1 ��
=0.15 molL-1min -1���ʴ�Ϊ��0.15molL-1min-1 ��
��Cl2(g)+CO(g)COCl2(g)����һ�δﵽƽ��״̬��c(CO)=0.1mol/L��c(Cl2)=0.3mol/L��c(COCl2)=0.9mol/L����Ӧ��һ�δ�ƽ��ʱ��ƽ�ⳣ��K=![]() =30��Ӱ��ƽ���ƶ����������¶ȡ�Ũ�Ⱥ�ѹǿ���÷�Ӧ�Ƿ��ȷ�Ӧ����ͼ��֪����10minʱƽ�������ƶ���ֻ�������£��ʴ�Ϊ��30�������¶ȣ�
=30��Ӱ��ƽ���ƶ����������¶ȡ�Ũ�Ⱥ�ѹǿ���÷�Ӧ�Ƿ��ȷ�Ӧ����ͼ��֪����10minʱƽ�������ƶ���ֻ�������£��ʴ�Ϊ��30�������¶ȣ�
(3)������������ǿ�������ԣ��ܹ������������������������������ӣ�������������ԭΪ���������ӷ���ʽ��2NO2+4HSO3-=N2+4SO42-+4H+���ʴ�Ϊ��2NO2+4HSO3-�TN2+4SO42-+4H+��
(4)A����Ӧ�ﵽƽ��ʱ���Ǹ����ʵ�Ũ�Ȳ��ٷ����ı�����������ȣ���A����B����Ϊ��Ӧ���ں����ܱ������н��еģ���Ӧ��������ﶼ�����壬������������������䣬������䣬�ܶȺ㶨���䣬���ܶȲ��䲻����Ϊ�ж�ƽ��ı�־����B����C����2v(N2)��=v(NO)��ʱ����Ӧ�ﵽƽ�⣬��C��ȷ��D����������������������䣬��������ʵ�����С��ƽ��Ħ��������������ʱ����Ӧ�ﵽƽ��״̬����D��ȷ���ʴ�Ϊ��CD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2ͨ��BaCl2��Һ�в�����������������ͼ�Ҳ��Y�ι��з��ú��ʵ�ҩƷ�����к�����������BaCl2��Һ�п��Կ�����ɫ�������Ҳ�Y�ι��зŵ�ҩƷ��( )

A. Cu��Ũ���� B. CaO��Ũ��ˮ
C. Na2SO3�ͽ�Ũ���� D. KMnO4��Һ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʹ�õ�ȼ�ϣ��ִ����ú����Һ��ʯ������ú������Ҫ�ɷ���CO��H2�Ļ�����壬����ú̿��ˮ������Ӧ�Ƶã����ֳ�ˮú����
��1����д����ȡˮú������Ҫ��ѧ����ʽ_________________________��
��2��Һ��ʯ��������Ҫ�ɷ��DZ��飬��֪���顢CO�Լ�����ȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ��
C3H8(g) +5O2(g) == 3CO2(g) + 4H2O(l) ��H= �C2220.0 kJ��![]()
CO(g) +1/2O2(g) == CO2(g) ��H= �C282.6kJ��![]()
2H2(g)+O2(g) == 2H2O(l) ��H= �C571.6 kJ��![]()
�ԱȽ�ͬ������H2��C3H8ȼ�գ�������������ֵԼΪ_______��(����������С�����һλ����)
��3������Դ��21���ͼ��߿���ǰ��������Դ֮һ����������ɫ��Դ���ֿ�ѭ��ʹ�á�
������ͼ�������տ�������ѭ�������еķ�Ӧ����������������������Դѭ����ϵͼ��ѭ���н���̫���ܵ���������Ȼ���й㷺���ڣ���

__________________________�� ___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ�Ӱ뾶��������X�Ƕ�����Ԫ����ԭ�Ӱ뾶��С�ģ�Z��Wͬ���壬��Z��W��ԭ������֮����Y��ԭ��������ͬ��X��Y��Z��W������������֮��Ϊ15������˵����ȷ���ǣ� ��
A. Z������WYZ�ڸ��������·�Ӧ����W���ʣ�˵���ǽ����ԣ�Z>W
B. ����ɫ��X2Z2Y4��Һ�еμ��������Ը��������Һ����Һ��Ϊ��ɫ��������X2Z2Y4�Ļ�ԭ��
C. Y��Z��W�ļ��⻯����ȶ���������ǿ
D. ��X��Y����Ԫ���γɵ����ӻ�������������ѧ����������ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��д����ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ�����������ͼ��

��1��ʵ���ұ��պ�������Ҫ���������е�_________(����ĸ)��
a���Թ� b���ձ� c������ d�������� e�������ż� f���ƾ���
��2��ָ����ȡ��Ĺ������йص�ʵ��������ƣ���________����________��
��3����ȡ��Ĺ����У���ѡ����л��Լ���________(����ĸ)��
A���ױ����ƾ� B�����Ȼ�̼���� C�����͡����� D�����͡�����
��4��С����CCl4��ȡ��ˮ�еĵ⣬����ͼ�ķ�Һ©���У��²�Һ���________ɫ����Һ©��������ȴδ��Һ�����£�ԭ�������___________________��

��5��ʵ������ȡFe(OH)3���廯ѧ��Ӧ����ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����Ȼ�����(S2Cl2)Ϊ�Ȼ�ɫҺ�壬��ˮ��ˮ�⣬��ҵ����������ijѧϰС�������������ʺϳ�S2Cl2��ʵ��װ����ͼ��ʾ.����˵����ȷ����

A. ʵ��ʱ���ȵ�ȼE���ľƾ���
B. C��D����ʢ�Լ�Ϊ�����Ȼ�����Һ��Ũ����
C. ���Ȼ�����(S2Cl2)ˮ�ⷴӦ����Ϊ:S��H2S��HCl
D. G�п��ռ��������IJ�Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ���������������ֶ�����Ԫ�أ�����ĸ x �ȱ�ʾ����ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯����ͼ��ʾ��

�����жϳ���Ԫ�ػش����⣺
��1��g �����ڱ��е�λ����__________��
��2��d��e��h �ļ����Ӱ뾶�ɴ�С˳��_____________(�����ӷ��ű�ʾ)��
��3���й� y��z��d ����Ԫ�ص�˵����ȷ����__________������ţ���
��������ۣ�d>z>y �ڼ���̬�⻯����ȶ��ԣ�d>z>y
�۷ǽ����ԣ�d>z>y �ܵ��ʻ����ԣ�y>z>d
��4������g ��h ����Ԫ����գ�
����������������Ӧˮ�����������ǿ������˳����____________��(�û�ѧʽ��ʾ)
��g2h2 ������ԭ�Ӷ����� 8 ���ӽṹ����д�������ʽ____________��
��5������д��x��d��e �γɻ������ˮ��Һ�뵥��f ��Ӧ�Ļ�ѧ����ʽ________________��
����֪������A��B ���� x��d��e��g ����Ԫ����ɣ���д��A ��B ��Ӧ�����ӷ���ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶�ѹǿ����ʱ��1mol NO2���·ֽ⣬����NO��O2���ﵽƽ��ʱ��������������ʵ�����Ϊ1.2mol����ʱNO2��ת����Ϊ
A. 10%B. 20%C. 40%D. 50%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com