
【题目】不属于硅酸盐工业产品的是
A. 水泥 B. 玻璃
C. 陶瓷 D. 化肥
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
A.Cu能与浓硝酸反应,但不能与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,高压放电时可反应
D.块状石灰石与盐酸反应比粉末状石灰石与盐酸反应慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:_______________________。
(2)光气(COCl2)是重要化工原料,常用于聚酯类材料的生产,工业通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=___________;
②该反应第一次达平衡时的平衡常数为___________,10min改变的条件是_____________。
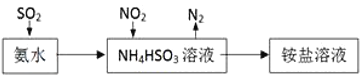
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:NO2被吸收的离子方程式是________________________________。
(4)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.2v(N2)正=v(NO)逆 D.容器中混合气体的平均摩尔质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法不正确的是
A. 明矾可用作净水剂
B. 热的纯碱溶液可以去除物品表面的油污
C. 氢氧化钠可用来治疗胃酸过多
D. 过氧化钠可用作潜艇里氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.80 mol·L-1 NaOH溶液 475 mL和0.40 mol·L-1硫酸500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是__________________(填仪器名称)。

(2)根据计算用托盘天平称取NaOH的质量为______g。其他操作均正确,实验中若还未等溶液冷却就定容了,则所得溶液浓度______0.80 mol·L-1。(填“大于”“等于”或“小于”)
(3)试通过计算,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。
(4)准确称量二水合草酸晶体(H2C2O4·2H2O)m g于锥形瓶中,加适量蒸馏水溶解,滴加2滴______指示剂,用未知浓度的NaOH溶液滴定到终点,终点的颜色变化是______;写出滴定反应的离子方程式:______。通过这种滴定方法,可以准确标定出NaOH溶液的浓度,假设消耗NaOH溶液的体积为VmL,列出计算NaOH准确浓度的式子:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中进行反应:3H2(g) + N2(g)![]() 2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
A. 10 sB. 20 sC. 30 sD. 40 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com