
【题目】下列物质不能通过化合反应制得的是
A.NaHCO3B.FeCl2C.Fe(OH)3D.H2SiO3
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
【题目】氮是与人类生活密切相关的一种重要元素。根据要求回答:
(1)写出N2的电子式_________;将空气中的氮气转化为含氮化合物的过程称为固氮,当今大规模人工固氮的主要方法是(用化学方程式表示)______________________________。
(2)某无色混合气体中可能含有NH3、O2、H2、NO、HCl等气体,将它通过浓H2SO4 后发现气体体积减少,将剩余气体与空气接触后呈红棕色,此混合气中一定不含有_________。
(3)实验室有多种制取氨气的方法,其中加热消石灰与氯化铵的混合固体就是方法之一。
①写出此反应的化学方程式:_____________________________________________。
②氨气可使湿润的红色石蕊试纸变蓝的原因(用相应的方程式说明)_______________。
③用乙装置(见图)吸收一段时间氨气后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,锥形瓶中不可能生成的物质是___(选填序号)。

a H2 b NO2 c HNO3 d NH4NO3
写出乙装置中氨催化氧化的化学方程式:__________________________。
(4)已知3Cl2+2NH3==N2 + 6HCl,若NH3过量则还有反应:NH3+ HCl== NH4Cl 。常温常压下,若在一密闭容器中将15mLCl2和40mL NH3充分混合反应后,剩余气体的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应2N2H4 + 2NO2 = 3N2 + 4H2O 中,氧化产物和还原产物的物质的量之比为 ( )
A. 1:1 B. 3:4 C. 4:3 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl和NaBr的混合溶液中,Na+、Br-、Cl-的物质的量浓度之比不可能出现的是 ( )
A. 3:2:2 B. 5:3:2 C. 5:4:1 D. 3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1 molL-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg![]() 随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是
随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是

A. HX的酸性弱于HY的
B. a点由水电离出的c(H+)=1×10-12 molL-1
C. c点溶液中:c(Y-)>c(HY)
D. b点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是( )

A. Cu和浓硝酸 B. CaO和浓氮水
C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,食品添加剂、感光剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。回答下列问题:
(1)水合肼的制备
有关反应原理为:NaClO+2NH3=N2H4·H2O+NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。
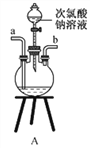
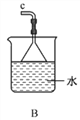
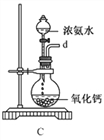

②装置C中发生反应的化学方程式为_____________________,装置D的作用是__________________。
(2)碘化钠的制备
步骤一:向三口烧瓶中加入8.2gNaOH及30mL水,搅拌冷却,加入25.4g单质碘,开动磁力搅拌器,保持60~70℃至反应充分;
步骤二:继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的某气体;
步耀三:向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
步骤四:将步骤三分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.3g。
①步骤一反应温度不宜超过70℃的原因是________________________;该步骤反应完全的现象是_______________________________。
②步骤二中IO-参与反应的离子方程式为_______________________________。
③步骤三“将溶液与活性炭分离”的方法是_____________________________。
④本次实验产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)滤液X中含有的金属阳离子是______(填离子符号)。
(2)步骤Ⅲ中可选用____(填字母)调节溶液的pH。
A.稀硝酸 B.氨水
C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是____________
(4)步骤Ⅳ的反应温度一般需控制在35 ℃以下,其目的是__________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com