
 NH3↑+H2O。综上所述,在溶液中肯定存在的离子有I-、NH4+、Ba2+;肯定不存在的离子有SO42-、CO32-、Mg2+、Al3+ 、Fe3+;根据溶液呈电中性原理,则溶液中还应该含有阴离子.要确定是否存在的阴离子的实验方法是取少量溶液于试管中,滴加稀硝酸,再滴加硝酸银溶液,如果有白色沉淀出现,说明含有该阴离子,否则不含有该阴离子。
NH3↑+H2O。综上所述,在溶液中肯定存在的离子有I-、NH4+、Ba2+;肯定不存在的离子有SO42-、CO32-、Mg2+、Al3+ 、Fe3+;根据溶液呈电中性原理,则溶液中还应该含有阴离子.要确定是否存在的阴离子的实验方法是取少量溶液于试管中,滴加稀硝酸,再滴加硝酸银溶液,如果有白色沉淀出现,说明含有该阴离子,否则不含有该阴离子。

科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B.在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C.一小块钠投入到CuSO4溶液中:2Na+Cu2+= Cu+2Na+ |
| D.铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2++ 2NO↑+ 4H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCO3-、H+、NO3-、Na+ |
| B.Na+、Cu2+、OH-、SO42- |
| C.Mg2+、H+、AlO2-、SO42- |
| D.NH4+、K+、Br-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0. 1mol·L-1NaOH 溶液: K+、Na+、SO42- 、CO32- |
| B.0. 1mol·L-1Na2CO3溶液:K+、Ba2+、NO3- 、Cl- |
| C.0. 1mol·L-1FeCl3溶液:K+、NH4+、I-、SCN- |
| D.c(H+)/c(OH-)= 1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知25℃时NH4CN水溶液显碱性,则25℃时的电离常数K(NH3·H2O)>K(HCN) |
| B.25℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| C.pH试纸测得新制氯水的pH为4.5 |
| D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液中:Fe3+、Cl-、NO3-、K+ |
| B.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO2-、NO3- |
| C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- |
| D.c(SO32-)=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+、H+、I-、Na+ |
| B.Al3+、Na+、AlO2-、SO42- |
| C.K+、NH4+、H+、CO32— |
| D.Cu2+、SO42—、Al3+、Cl— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、
、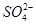 、Cl-、I-、
、Cl-、I-、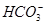 ,取该溶液进行如下实验:
,取该溶液进行如下实验:| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③ | C.②④ | D.②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com