
【题目】以铝土矿(主要成分是Al2O3,杂质有SiO2、Fe2O3等)为原料,采用拜耳法生产Al2O3的流程如下图所示:
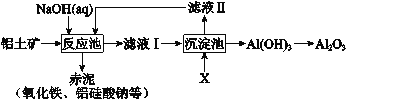
(1)Al2O3可用于电解制Al,其反应的化学方程式是_______。
(2)调控反应池中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀。Al2O3溶于NaOH的离子方程式是_______。
(3)该生产过程中,需向沉淀池中加入X。
① X 可为过量的CO2,则滤液II中主要的溶质是_______,为了使滤液II循环利用,应补充的物质是_______(选填字母);
a.CaO b.HCl c.Na2CO3
② X 也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是_______。
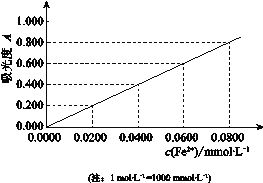
(4)测铝土矿中铝元素含量:
I 将m g铝土矿样品经处理配成V mL溶液
II 取少量该溶液用EDTA法测得该溶液中Fe3+、Al3+浓度之和为a mol·L-1
III 另取少量该溶液,将Fe3+用盐酸羟胺还原为Fe2+后,利用吸光度法测得吸光度为0.400(吸光度与Fe2+浓度对应曲线如下图),该铝土矿样品中铝元素的质量分数表达式是_______(用字母表示)。
【答案】(1) ![]()
(2)Al2O3+2OH-=2AlO2-+H2O
(3)① NaHCO3 a ② 滤液II可直接循环使用。
(4)27V(a-0.0400×10-3)/1000m
【解析】
试题分析:(1)工业上用电解熔融的Al2O3制取金属Al,氧化铝的熔点很高,需要冰晶石(Na3AlF6)做助溶剂,反应的化学方程式为![]() 。
。
(2)Al2O3属于两性氧化物,能与NaOH反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(3)① 根据流程图可知,滤液Ⅰ是偏铝酸钠溶液,碳酸的酸性强于Al(OH)3,所以CO2能与NaAlO2溶液反应生成白色沉淀Al(OH)3 ,若CO2过量,生成NaHCO3,所以滤液II中主要的溶质是NaHCO3 ;因为NaHCO3在碱性环境中的反应,可以使用生石灰将NaHCO3转化为CaCO3 和NaOH,答案选a。
② 根据题意,引入Al(OH)3晶种能够产生Al(OH)3沉淀,其优点是滤液II可直接循环使用。
(4)根据图像可知,c(Fe2+)浓度为0.04m mol/L,根据铁原子守恒,则c(Fe3+)=0.04×10-3mol/L,因为Fe3+、Al3+浓度之和为a mol·L-1,所以c(Al3+)=a-0.4×10-3,所以该铝土矿样品中铝元素的质量分数表达式是27V(a-0.0400×10-3)/1000m。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
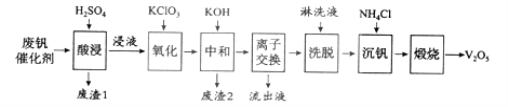
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照一定标准,根据物质与水反应的不同情况,对下列物质进行分类,如图所示,请填空:

(1)上图中分类标准1(分成A、B组的依据)为______________________________。
(2)工业上常用D组中________(填化学式)来消除C组中物质对大气的污染,涉及反应的化学方程式为______________________________ 。
(3)实验室由Al3+制备Al(OH)3时,应选择D组中________(填化学式)的水溶液,
离子方程式为______________________________________。
(4)F组中有两种物质,在工业上均有重要的用途,请各写出一个化学方程式表示其用途:
__________________________________、__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盛有氯化钡稀溶液的甲乙两试管分别通入SO2至饱和,若向甲试管中加入足量氯水,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
A.甲管没有白色沉淀生成而乙试管有
B.甲管有白色沉淀而乙试管没有
C.甲、乙两试管都有白色沉淀生成
D.甲、乙两管都没有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.由 D和18O所组成的水11g,所含中子数为4NA
B.1 L 0.4 mol·L-1稀硝酸与Fe完全反应,转移电子数为0.3NA
C.标准状况下,2.24LCHCl3所含分子数为 0.1NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机推断题。有机物G是一种医药中间体,可通过如图所示路线合成。A的产量是衡量一个国家石油化工发展水平的重要标志,H的分子式是C7H8。
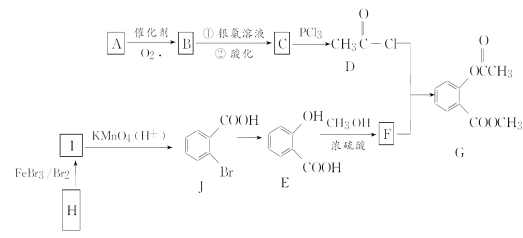
已知:![]()
请回答以下问题:
(1)A的结构简式是________。
(2)H→I的化学反应方程式为___ _____,
E→F的化学方程式为_________________ ______________。
(3)C→D的反应类型是________,I→J的反应类型是________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_________。
(5)满足以下条件的F的同分异构体还有________种(不包含F)。
①能与氯化铁溶液发生显色反应
②红外光谱等方法检测分子中有“COO”结构
③苯环上有两个取代基
其中能与碳酸氢钠溶液反应且核磁共振氢谱测定有5个吸收峰的同分异构体的结构简式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19世纪中叶,俄国化学家门捷列夫( )
A. 提出了原子分子学说 B. 提出了元素周期律
C. 制出了第一张元素周期表 D. 发现了质量守恒定律
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( )
选项 | 物质及其杂质 | 检验方法 | 除杂 |
A | Cl2(HCl) | 通入AgNO3溶液中 | 饱和食盐水 |
B | FeCl2溶液(FeCl3) | 滴入KSCN溶液 | 通入过量氯气 |
C | 苯(苯酚) | 滴入FeCl3溶液 | 碱洗分液 |
D | KNO3晶体(NaCl) | 焰色反应 | 重结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com