
����Ŀ������ͼ��ʾ��װ���У�A����������������C��DΪ���徻��װ��(C��װ�б���ʳ��ˮ��D��װ��Ũ����)��E��Ӳ�ʲ�����װ��ϸ��˿����FΪ����Ŀչ��ƿ���ձ�G��װ������������Һ����ش��������⣺
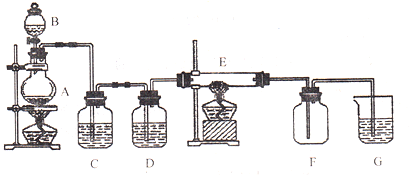
��1������A��������______________��
��2�������ʵ�����������Ļ�ѧ����ʽ��![]() ________
________![]()
��3��Cװ�õ�������_____________________��Dװ�õ�������_____________________��
��4��E�з�����ѧ��Ӧ�ķ���ʽΪ��_________________________________________��
��5���ձ�G�з�����Ӧ�Ļ�ѧ����ʽΪ��________________________________________��
���𰸡�Բ����ƿ MnCl2 ��ȥ���������е��Ȼ������� �������� 2Fe+3Cl2![]() 2FeCl3 Cl2+2NaOH=NaCl+NaClO+H2O
2FeCl3 Cl2+2NaOH=NaCl+NaClO+H2O
��������
�ڼ��������£��������̺�Ũ���ᷴӦ�����������Ȼ��̺�ˮ��Ũ������лӷ��ԣ�������ȡ�������к���HCl��HCl��������ˮ������ʳ��ˮ�к������������������ܽ⣬�����ñ���ʳ��ˮ�����Ȼ��⣻D�к���Ũ���ᣬŨ���������ˮ�ԣ�������������ڼ��������£���˿����������������ԭ��Ӧ�����Ȼ����������ܶȴ��ڿ����ҳ����ºͿ�������Ӧ�����Բ��������ſ������ռ������������ж�����ֱ���ſգ������ü������������������Դ˽���⡣
��1������A��������Բ����ƿ��
��2�����������£��������̺�Ũ���ᷴӦ�����������Ȼ��̺�ˮ����Ӧ����ʽΪ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
�ʴ�Ϊ��MnCl2��
��3��Ũ������лӷ��ԣ�������ȡ�������к���HCl��HCl��������ˮ������ʳ��ˮ�к������������������ܽ⣬�����ñ���ʳ��ˮ�����Ȼ��⣻Ũ���������ˮ�Զ�����������
�ʴ�Ϊ����ȥ���������е��Ȼ������壻����������
��4���ڼ��������£���˿����������������ԭ��Ӧ�����Ȼ�������Ӧ����ʽΪ2Fe+3Cl2![]() 2FeCl3��
2FeCl3��
��5�������ж�����ֱ���ſգ������ͼ������ʷ�Ӧ���������ʣ�����Eװ�õ����������ն������������Ӧ����ʽΪCl2+2NaOH=NaCl+NaClO+H2O��


 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��̽��ij����M�����ʽ���������ʵ�飬ʵ����̼�������ͼ��ʾ�����ʵ�������жϣ���ͬѧ�ó������н�������ȷ����![]()
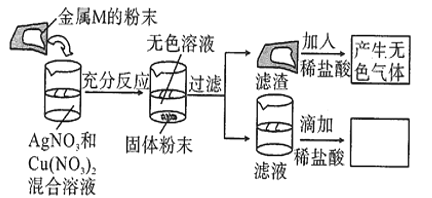
A.����Ľ���M��������
B.����Һ�еμ������ʵ�������Dz�����ɫ����
C.���ַ�Ӧ��δ���˵Ļ�����м���ϡ���ᣬ��������ɫ����һ����![]()
D.������һ�����н���M
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж����з�������ԭ�ӵ��ӻ����ͺͷ��ӹ��͡�
��1��NI3��______��
��2��CH3Cl��______��
��3��CO2��______��
��4��BF3��______��
��5��H2O��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƽ�������ʾ�����������в��������ķϲ�����ĩ(��SiO2��Fe2O3��CeO2��FeO������)��ij�������Դ˷�ĩΪԭ�ϣ�������¹������̶���Դ���л��գ��õ�Ce(OH)4��������泥�

��֪��
�����������£�����ˮ��Һ����Ce3+��Ce4+������Ҫ������ʽ��Ce3+��ˮ�⣬Ce4+�н�ǿ�����ԡ�
��CeO2������ϡ���ᡣ
���������[aFe2(SO4)3b(NH4)2SO4cH2O]�㷺����ˮ�ľ���������
(1)���������ڣ��������������ʺ�����������B���� (�����)��
a��NaClO b��H2O2 c��KMnO4
(2)������������� ���������������Һ�к���NH4+�ķ����� ��
(3)д����Ӧ�ڵĻ�ѧ����ʽ ��
(4)�õζ����ⶨ�Ƶõ�Ce(OH)4��Ʒ���ȡ���ȡCe(OH)4��Ʒ���������ܽ����0.1000mol/LFeSO4��Һ�ζ�������FeSO4��Һ�ڿ�����¶��һ��ʱ����ٽ��еζ������ø�Ce(OH)4��Ʒ���������� ��(�ƫ����ƫС������Ӱ�족)
(5)��ȡ14.00g���������Ʒ����������ˮ���Ƴ�100mL��Һ���ֳ����ȷݣ�������һ�ݼ�������NaOH��Һ������ϴ�ӳ�����������������صõ�1.60g���壻����һ����Һ�м���0.5mol/L Ba(NO3)2��Һ100mL��ǡ����ȫ��Ӧ��ͨ�����㣬��������淋Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ���й�Ӧ�õ������У���ȷ���ǣ� ��
A.�����ȼ����Ϊ890.3kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+![]() O2(g)�TCO(g)+2H2O(l) ��H=-890.3kJmol-1
O2(g)�TCO(g)+2H2O(l) ��H=-890.3kJmol-1
B.��֪ǿ����ǿ����ϡ��Һ�ﷴӦ���к���Ϊ57.3kJmol-1����![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)�T
Ba(OH)2(aq)�T![]() BaSO4(s)+ H2O(l) ��H<-57.3kJmol-1
BaSO4(s)+ H2O(l) ��H<-57.3kJmol-1
C.500�桢30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H=-38.6kJmol-1
2NH3(g) ��H=-38.6kJmol-1
D.��֪25�桢101KPa�����£�4Al(s)+3O2(g)�T2A12O3(s)��H=-2834.9kJmol-1��4Al(s)+2O3(g)�T2A12O3(s) ��H=-3119.1kJmol-1����O3��O2�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������20mL 0.2mol/L H2A��Һ�еμ�0.2mol/L NaOH��Һ���й��������ʵ����仯����ͼ(���Т����H2A�����HA-�����A2-)����ͼʾ�ж�����˵����ȷ����( )
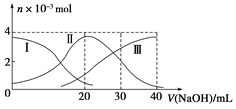
A.H2A��ˮ�еĵ��뷽��ʽ�ǣ�H2A=H+��HA-��HA-H+��A2-
B.��V(NaOH)��20mLʱ��Һ�и�����Ũ�ȵĴ�С˳��Ϊ��c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.�������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ��
D.��V(NaOH)��30mLʱ����Һ�д������¹�ϵ��2c(H+)��c(HA-)��2c(H2A)��c(A2-)��2c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º����ܱ������з�����ӦNH2COONH4��s��2NH3��g��+CO2��g���������жϸ÷�Ӧ�Ѵﵽ��ѧƽ����ǣ� ��
A. v����NH3��=2v����CO2�� B. �ܱ������л�������ƽ��Ħ����������
C. �ܱ������л��������ܶȲ��� D. �ܱ���������ѹǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ϢϢ��أ�����������ʳƷ��ȫԽ��Խ�ܵ����ǵĹ�ע��
(1)�����������������������ͬ�ĺ������Իش��������⣺
��Ϊȷ���������������ʴﵽ95������ ����������״������У�����Ҫ����ָ������________��
A�������������(pm2.5�� B��NO2 Ũ�� C��SO2Ũ�� D��CO2Ũ��
����ɳ�����ն�����Ҫ������_____________________��
����ɫ����������֮һ�Ƕ�����̼���ŷš�Ϊ����Ӧ��̼����ι���������� __________(A����˽�ҳ� B���˹�����)������ͣ��������װ������β���������ʩ�� д������β����CO��NO��������ɿɲ������ѭ������������Ļ�ѧ����ʽ��
____________________________________________________________________��
(2)��������ˮƽ����ߣ�����Խ��Խ��ע�����Ľ�����������̽�ֻ�ѧ���������彡�� ���й����⣺��Ԫ�������彡��������أ�����ʳ�ṹ������������ij����Ԫ�ز� �㣬�ͻ�����ijЩ�����������״���״�(�׳ƴ��Ӳ�)������������ȱ_________��������Ԫ��������������ܻᵼ��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�У���������ˮ�������ɵ�H+Ũ��֮��(�٣��ڣ��ۣ���)��(����)
��pH=0������ ��0.1molL��1������ ��0.01molL��1��NaOH��Һ��pH=11��NaOH��Һ��
A.1��10��100��1 000B.0��1��12��11
C.14��13��12��11D.14��13��2��3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com