
【题目】常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2AⅡ代表HA-Ⅲ代表A2-)根据图示判断下列说法正确的是( )
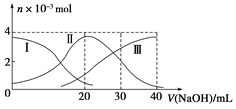
A.H2A在水中的电离方程式是:H2A=H++HA-、HA-H++A2-
B.当V(NaOH)=20mL时溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大
D.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
【答案】B
【解析】
图中曲线I为H2A,溶液中存在酸的分子,说明为弱酸;当V(NaOH)=20mL时,溶液主要为NaHA,电离为主,溶液显酸性,根据电荷守恒和物料守恒分析。
A. H2A为弱酸,电离方程可逆,在水中的电离方程式是H2AH++HA-、HA-H++A2-,A错误;
B. 当V(NaOH)=20mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,故溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),B正确;
C. 等体积等浓度的NaOH溶液与H2A溶液混合后,溶液主要为NaHA,电离为主,溶液显酸性,溶液中的氢离子会抑制水的电离,所以溶液中水的电离程度比纯水小,C错误;
D. 当V(NaOH)=30mL时,溶液中电荷守恒为:c(H+)+c(Na+)=c(HA-)+2c(A2-)+c(OH-),物料守恒为:2c(Na+)=3c(HA-)+3c(A2-)+3c(H2A),所以溶液中存在以下关系:2c(H+)+3c(H2A)═c(A2-)+2 c(OH-),D错误。
答案为B。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
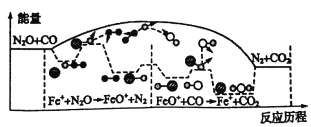
A. 反应总过程△H<0
B. Fe+使反应的活化能减小
C. 总反应若在2L的密闭容器中进行,温度越高反应速率一定越快
D. Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热及应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是()

A. 分子中每个原子最外层均达到8电子稳定结构
B. P4S3中硫元素为-2价,磷元素为+3价
C. 一个P4S3分子中含有三个非极性共价键
D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是

A. 逐滴加入饱和食盐水可控制生成乙炔的速率
B. 用溴水验证乙炔的性质,不需要除杂
C. KMnO4酸性溶液褪色,说明乙炔具有还原性
D. 将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水.D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G中装有氢氧化钠溶液。请回答下列问题:
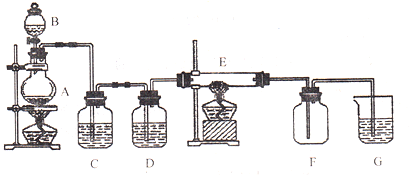
(1)仪器A的名称是______________;
(2)请完成实验室制氯气的化学方程式:![]() ________
________![]()
(3)C装置的作用是_____________________;D装置的作用是_____________________;
(4)E中发生化学反应的方程式为:_________________________________________;
(5)烧杯G中发生反应的化学方程式为:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一。![]() 丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是
丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是![]()
![]()
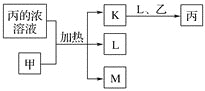
A.氢化物的沸点:![]()
B.元素的非金属性:![]()
C.化合物![]() 和XYZ中均只含极性键
和XYZ中均只含极性键
D.丙也可由W、Y组成的某种化合物与K直接反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A.用排饱和食盐水的方法收集氯气
B.合成氨工业选择高温
C.开启啤酒瓶后,瓶中马上泛起大量泡沫
D.在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个恒温恒容的密闭容器中充入1 mol HI,建立如下平衡:2HI(气)![]() H2(气)+I2(气),测得HI的转化率为a%。保持恒温恒容,在上述平衡体系中再充入2molHI,待新平衡建立后HI的转化率为b%,则a与b的关系是
H2(气)+I2(气),测得HI的转化率为a%。保持恒温恒容,在上述平衡体系中再充入2molHI,待新平衡建立后HI的转化率为b%,则a与b的关系是
A.a>b B.a<b C.a=b D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①则反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
②根据表中数据,可推知该反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
(2)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
(3)在容积为VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。
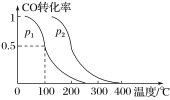
①p1__(填“大于”“小于”或“等于”)p2。
②在其他条件不变的情况下,再增加amolCO与2amolH2,达到新平衡时,CO的转化率__(填“增大”“减小”或“不变”,下同),平衡常数__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com