
【题目】下列四种溶液中,室温下由水电离生成的H+浓度之比(①:②:③:④)是( )
①pH=0的盐酸 ②0.1molL﹣1的盐酸 ③0.01molL﹣1的NaOH溶液④pH=11的NaOH溶液.
A.1:10:100:1 000B.0:1:12:11
C.14:13:12:11D.14:13:2:3
【答案】A
【解析】
电离平衡为H2OH++OH﹣,在水中加入酸或者碱溶液,导致溶液中氢离子或者氢氧根离子浓度增大,抑制了水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,据此计算出各项水电离的氢离子浓度.
酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的,
①pH=0的盐酸,溶液中氢离子浓度为1mol/L,水电离的氢氧根离子为:![]() mol/L=1×10﹣14mol/L;
mol/L=1×10﹣14mol/L;
②0.1mol/L盐酸,溶液中氢离子浓度为0.1mol/L,水电离的氢氧根离子为:![]() mol/L=1×10﹣13mol/L;
mol/L=1×10﹣13mol/L;
③0.01mol/L的NaOH 溶液,溶液中氢离子浓度为:![]() mol/L=1×10﹣12mol/L;
mol/L=1×10﹣12mol/L;
④pH=11的NaOH 溶液,溶液中氢离子浓度为:1×10﹣11mol/L;
所以由水电离产生的c(H+)之比①:②:③:④=1×10﹣14mol/L:1×10﹣13mol/L:1×10﹣12mol/L:1×10﹣11mol/L=1:10:100:1000,故选A。


科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水.D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G中装有氢氧化钠溶液。请回答下列问题:
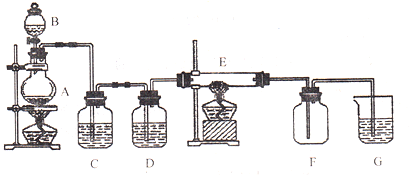
(1)仪器A的名称是______________;
(2)请完成实验室制氯气的化学方程式:![]() ________
________![]()
(3)C装置的作用是_____________________;D装置的作用是_____________________;
(4)E中发生化学反应的方程式为:_________________________________________;
(5)烧杯G中发生反应的化学方程式为:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海底有大量的天然气水合物,可满足人类1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为
A.CH4·14H2O
B.CH4·8H2O
C.CH4·![]() H2O
H2O
D.CH4·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示转化关系(X代表卤素),说法不正确的是( )
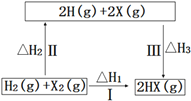
A.2H(g)+2X(g)=2HX(g) △H3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3
C.途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定
D.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
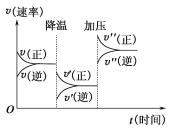
A.温度越高,该反应的化学平衡常数越大B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应D.A、B、C、D均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①则反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
②根据表中数据,可推知该反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
(2)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
(3)在容积为VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。
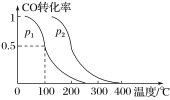
①p1__(填“大于”“小于”或“等于”)p2。
②在其他条件不变的情况下,再增加amolCO与2amolH2,达到新平衡时,CO的转化率__(填“增大”“减小”或“不变”,下同),平衡常数__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+ 4B(g)![]() C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(NaUr)与pH的关系如图所示。已知:Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法正确的是![]()
![]()
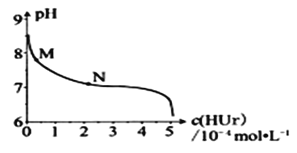
A.上层清液中,c(Ur-)=7.0×10-2molL-1
B.在M→N的变化过程中,c(Na+)c(Ur-)的值保持不变
C.当c(NaUr)= c(Ur-)时,c(Cl-)>c(Ur-)
D.当pH=7时,2c(Na+)=c(Ur-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
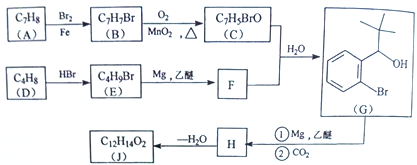
己知: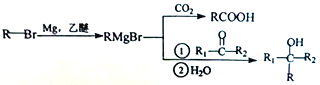
(1)G中官能团的名称为_________、_________。
(2)D的系统命名是_________。
(3)由A生成B的化学方程式为_________,反应类型_________。
(4)C与银氨溶液反应的化学方程式为________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_________。
(6)写出一种同时满足下面条件的G的同分异构体的结构简式_________。
①核磁共振氢谱有4组峰②能与FeCl3溶液发生显色反应
(7)借助题中信息写出以乙醛和苯为原料,合成 的路线流程图(其它试剂自选)。_________________________________________________________。
的路线流程图(其它试剂自选)。_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com