
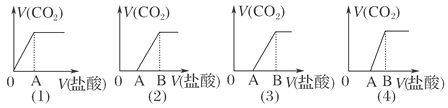
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别为OA<AB,OA=AB,OA>AB,则下列分析与判断正确的是(不计CO2的溶解)( )
A. (1)图显示M中只有一种溶质且为Na2CO3
B. (3)图显示M中有两种溶质且为Na2CO3、NaOH
C. (2)图显示M中有两种溶质且为Na2CO3、NaHCO3
D. (4)图显示M中Na2CO3=NaHCO3
【答案】C
【解析】
向NaOH溶液中通入CO2所得溶液M中的溶质有4种情况:①NaOH和Na2CO3、②Na2CO3、③Na2CO3和NaHCO3、④NaHCO3;向M中逐滴加入盐酸可能发生的反应有NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,由方程式可知Na2CO3转化为等物质的量的NaHCO3消耗的盐酸与该NaHCO3完全反应消耗的盐酸相等;(1)图加入盐酸立即产生CO2,溶质只有NaHCO3;(2)图OA<AB,溶质为Na2CO3和NaHCO3;(3)图OA=AB,溶质只有Na2CO3;(4)图OA>AB,溶质为NaOH和Na2CO3。
向NaOH溶液中通入CO2所得溶液M中的溶质有4种情况:①NaOH和Na2CO3、②Na2CO3、③Na2CO3和NaHCO3、④NaHCO3;
A项,(1)图向M溶液中加入盐酸立即产生CO2,说明M中只有一种溶质,溶质为NaHCO3,A项错误;
B项,(3)图中OA=AB,向M溶液中加入盐酸,不产生CO2消耗的盐酸与产生CO2消耗的盐酸相等,说明M中只有一种溶质,溶质为Na2CO3,B项错误;
C项,(2)图中OA<AB,不产生CO2消耗的盐酸<产生CO2消耗的盐酸,说明M中含两种溶质,两种溶质为Na2CO3和NaHCO3,C项正确;
D项,(4)图中OA>AB,不产生CO2消耗的盐酸>产生CO2消耗的盐酸,说明M中含两种溶质,两种溶质为NaOH和Na2CO3,不存在NaHCO3,D项错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】均由两种短周期元素组成的A、B、C三种化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4。A和C分子中,其原子个数比都为1:1,B分子中原子个数比为1:2。由两种短周期元素组成的双核D离子中含有10个电子,它与A、B分子均能反应,生成一种常见的10电子分子E。请回答下列问题:
(1)C的化学式为_____。A的还原性______B的还原性(填“大于”或“小于”)
(2)写出B与D在溶液中反应的离子方程式__________。
(3)气态的A分子遇到某10电子分子会产生白烟,请写出该白烟成分的电子式_______;该白烟的水溶液与浓的含D离子的溶液在受热条件下反应的离子方程式为_________。
(4)写出一个含有18电子的五原子分子的化学式_______,其中的一种元素形成的单质可被含D离子的溶液腐蚀,发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A. 混合气体的压强B. 混合气体密度
C. A的物质的量浓度保持不变D. 气体总物质的量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
半导体材料磷化硼(BP)可由BBr3和PBr3在高温下合成。回答下列问题:
(1)基态P原子的价电子排布式为__________,同周期中第一电离能比P 小的元素有______种。
(2)在水中的溶解度BBr3_______PBr3(填“ >”或“ <”),原因是_____________。
(3)一定温度下PBr5能形成阴、阳离子个数比为1:1的导电熔体,经测定其中P—Br键键长均相等。写出该导电熔体中阳离子的电子式:_________,其中P原子的杂化轨道类型是_______。
(4)已知磷化硼晶体中P原子作A1型最密堆积,B原子填入四面体空隙中,相邻P原子和B原子核间距为d cm,则该晶体中每个B原子周围有_____个B原子与它距离最近,晶体密度为____g·cm-3(NA表示阿伏加德罗常数的值),若某个P原子的坐标为(0,0,0),则晶胞中其余P原子的坐标为__________(写出一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.1 mol·L-1CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、量筒、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算,应选择下列________。
A.需要CuSO4固体8 g B.需要CuSO4·5H2O晶体12.0 g
C.需要CuSO4·5H2O晶体12.5 g D.需要CuSO4固体7.7 g
(3)称量。所用砝码生锈则所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是____________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。
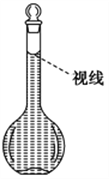
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以芳香烃A为原料发生如下图所示的变化,可以合成两种高聚物G和H。已知:两个羟基连在同一碳原子上不稳定,会自动脱水。

回答下列问题:
(1)A 中官能团的名称是_____________;C的结构简式为_____________。
(2)B→C的反应条件是____________,D→E的反应类型是_______________。
(3)写出E→G 的化学方程式:_____________________。
(4)E的同分异构体中,苯环上有4 个取代基、遇FeCl3溶液显紫色且能与碳酸氢纳溶液反应生成 CO2的共 有__________种(不考虑立体异构),其中核磁共振氢谱显示有4 种不同化学环境的氢的结构简式为_____________(写出一种即可)。
(5)参照上述合成路线,以丙炔为原料(无机试制任选),设计可降解塑料聚乳酸(PLA)的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生产、人类生活密不可分,下列说法正确的是( )
A.利用晶体硅制作的太阳能电池将太阳能直接转化为电能
B.发展汽车产业,鼓励私人购车,可以提高出行效率,应该大力提倡
C.农作物收割后留下的秸秆可以就地焚烧
D.镀镍后的废液可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料开采、加工过程产生的H2S废气可以通过多种方法进行治理.可以制取氢气,同时回收硫单质,既廉价又环保。回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g) △H1
S(s)+ O2(g)=SO2(g) △H2
2S(s)![]() S2(g) △H3
S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g)![]() 2H2(g)+ S2(g)的△H=_____
2H2(g)+ S2(g)的△H=_____
(2)工业上采州高温热分解HzS的方法制取H2,在膜反应器中分离出H2。
在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:![]() ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
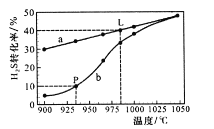
①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=________。
②温度升高,平衡向____方向移动(填“正反应”“逆反应”),平衡常数____(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为________。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是___________。
(3)电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。

①进入电解池的溶液中,溶质是____。
②阳极的电极反应式为________________。
③电解总反应的离子方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com