
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. 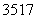 Cl与
Cl与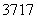 Cl得电子能力相同
Cl得电子能力相同
科目:高中化学 来源: 题型:
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
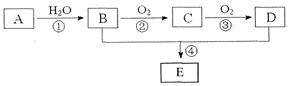
请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,____________________;
④____________________,____________________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E_________,原因是__________。
(4)若184gB和120gD反应能生成106gE,则该反应的产率______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO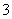 +3HSO
+3HSO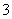 ===3SO
===3SO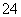 +Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。上图为用ClO
+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。上图为用ClO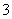 在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )
在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )
A.反应开始时速率增大可能是c(H+)增大引起的
B.纵坐标为v(H+)的速率—时间曲线与图中曲线能完全重合
C.后期反应速率下降的主要原因是反应物的浓度减小
D.图中的阴影部分“面积”为t1~t2时间内ClO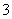 的物质的量浓度的减小值
的物质的量浓度的减小值
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定的温度、压强下,向100mL CH4和Ar的混合气体中通入400mL O2,点燃使其完全反应,最后在相同条件下得到干燥气体460 mL,则反应前混合气体中CH4和Ar的物质的量之比为( )
A.1:4 B.1:3
C.1:2 D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)的原子核外有1个电子
B. 1 H与D互称同位素
C.H2O与D2O互称同素异形体
D. 1H O与D
O与D O的相对分子质量相同
O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
4种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性。回答下列问题:
| M | N | ||
| X | Y |
(1)元素X在周期表中的位置是第________周期、第________族,其单质可采用电解熔融________的方法制备。
(2)M、N、Y三种元素最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是________。(填化学式)
(3)气体分子(MN)2的电子式为________。(MN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M与X同主族,与W同周期。
(1)M元素是________(填元素符号)。
(2)Z、W形成的气态氢化物的稳定性为______>________________________________________________________________________
(填化学式)。
(3)M2Z2的电子式为________________,写出M2Z2与水反应的离子方程式:________________________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为__________________________________________。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知:
①1 mol A能与足量NaOH浓溶液反应生成标准状况下44.8 L气体;
②A能与盐酸反应产生气体B,该气体能与氯水反应。
则A是____________(填化学式);写出该气体B与氯水反应的离子方程式:________________________________________________。
(6)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物C,1 mol C中含有6 mol结晶水。对该化合物C进行以下实验:
a.取C的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色、有刺激性气味的气体。过一段时间,白色沉淀变为灰绿色,最终变为红褐色;
b.另取C的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①写出C的化学式:________________________________________________________________________。
②试写出C与M2Z2按物质的量比1∶2在溶液中反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.0.01mol/L NH4Al(SO4)2溶液与0.02 mol/LBa(OH)2溶液等体积混合产生沉淀:
NH4++Al3++2SO42−+2Ba2++4OH−=2BaSO4↓+ Al(OH)3↓+NH3·H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:
2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
D.向FeCl3溶液中加入Na2S溶液产生沉淀:2Fe3++3S2-+6H2O=2Fe(OH)3↓+3H2S↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com