
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下,下列说法错误的是( )
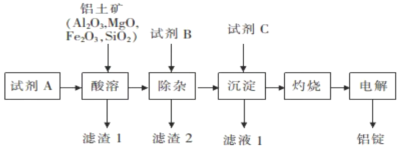
已知:滤渣2主要成分是氢氧化铁、氢氧化镁,B的焰色呈黄色。
A.试剂A可以是稀硫酸或盐酸B.加入试剂B除去![]() 、
、![]()
C.滤渣1的主要成分是![]() D.电解氯化铝也可以制取铝
D.电解氯化铝也可以制取铝
【答案】D
【解析】
由流程可知试剂A的目的是将铝土矿中的金属氧化物溶解,因此试剂A可以是稀硫酸或稀盐酸,滤渣1为二氧化硅,过滤后加入试剂B为NaOH,可除去溶液中的Mg2+、Fe3+,滤渣2为氢氧化镁、氢氧化铁等,滤液中含有NaAlO2,可通入二氧化碳气体,生成氢氧化铝沉淀,经过滤、洗涤、灼烧得到氧化铝,电解熔融的氧化铝,得到铝。
A项、由流程可知试剂A的目的是将铝土矿中的金属氧化物溶解,因此试剂A可以是稀硫酸或稀盐酸,故A正确;
B项、加入盐酸后溶液中含有Mg2+、Fe3+,过滤后加入试剂B为NaOH,可除去溶液中的Mg2+、Fe3+,故B正确;
C项、由以上分析可知滤渣1的主要成分是SiO2,故C正确;
D项、氯化铝为共价化合物,熔融状态下不导电,应电解氧化铝,故D错误;
故选D。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5 mol·L-1的Na2CO3溶液1 000 mL,假如其他操作均是正确无误的,下列情况会引起配制溶液的浓度偏高的是( )
A. 称取碳酸钠晶体100 g
B. 定容时,俯视观察刻度线
C. 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
D. 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为合成1-丁醇,查阅资料得知如下合成路线:CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:CO的制备原理:HCOOH![]() CO↑+H2O.(常温下甲酸为液体)
CO↑+H2O.(常温下甲酸为液体)
(1)原料气CH3CH=CH2、CO和H2的制备均可用图1装置:
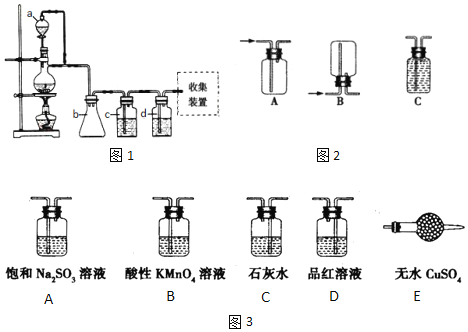
填写下列空白:
①若用上述装置制备氢气,收集装置可选用图2下列______装置
②若用上述装置制备干燥纯净的CO气体,装置b的作用是______;c中盛装的试剂是______。
为了控制生成一氧化碳的速度,则分液漏斗a中盛装的试剂是______。
③实验室用浓硫酸和2-丙醇制备丙烯时,还产生少量SO2、CO2及水蒸气,该小组用图3试剂检验这四种气体,混合气体通过试剂的顺序是______(填序号,试剂可以重复使用);写出2-丙醇与浓硫酸反应生成SO2、CO2及水蒸气的化学方程式______;
(2)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______。
a.低温、高压、催化剂b.适当的温度、高压、催化剂
c.常温、常压、催化剂d.适当的温度、常压、催化剂
(3)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如图提纯路线:
![]()
试剂1为______,操作3为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol/L的是( )
A.将40g NaOH溶解在1L水中
B.将22.4L HCl气体溶于水配成1L溶液
C.将1L 10 mol/L浓盐酸加入9L水中
D.将10g NaOH溶于少量水,在稀释到溶液为250ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
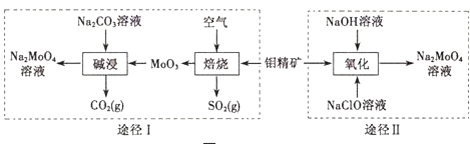
(1)钼和锆同属过渡金属,锆元素是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是______(填序号)
A 锆合金比纯锆的熔点高,硬度小
B 二氧化锆陶瓷属于新型无机非金属材料
C 将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)①途径I碱浸时发生反应的离子方程式为______.
②途径Ⅱ氧化时发生反应的离子方程式为______.
(3)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是______.
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:
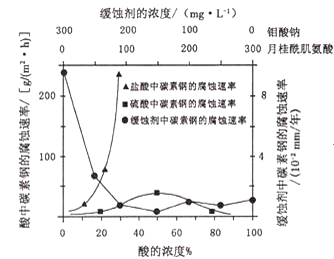
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为______。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是______。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:

下列说法错误的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
C. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
D. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于①NaHCO3②Na2CO3③CH3COOH④CH3COONa四种溶液物质的量浓度均为0.01mol/L,下列说法正确的是()
A.①中加入NaOH固体,![]() 增大
增大
B.②的离子浓度为:c(Na+)>c(OH-)>c(CO32-)>c(H+)
C.③溶液中加入等体积的水稀释,溶液中所有离子浓度都减小
D.②和④等体积混合:c(Na+)>c(CH3COO-)+2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:

下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c,d均是热和电的良导体。下列说法不正确的是
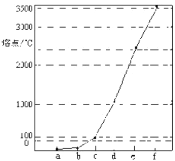
A.e、f单质晶体熔化时克服的是共价键
B.d单质对应元素原子的电子排布式:1s22s22p63s23p2
C.b元素形成的气态氢化物易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含2个σ键,2个π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com