
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:

下列说法错误的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
C. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
D. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为___________________________。
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890.3 kJ/mol
C2H2(g)+2.5O2(g)===2CO2(g)+H2O(l) ΔH2=-1299.6 kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH3=-571.6 kJ/mol
则甲烷气相裂解反应:2CH4(g)===C2H2(g)+3H2(g)的ΔH=________kJ/mol。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向1 L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g) ![]() C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的ΔH_____0(填“>”或“<”),CH4的平衡转化率为________。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01 mol/(L·s)的平均速率增多,经t s后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>” 或“<”)T2,t=________s;
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的ΔH_____0(填“>”或“<”),CH4的平衡转化率为________。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01 mol/(L·s)的平均速率增多,经t s后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>” 或“<”)T2,t=________s;
②列式计算反应2CH4(g) ![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=__________________(用平衡分压代替平衡浓度计算,lg0.05=-1.3);
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=__________________(用平衡分压代替平衡浓度计算,lg0.05=-1.3);
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
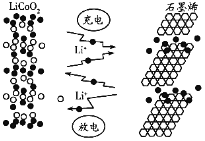
A. 充电时,![]() 嵌入
嵌入![]() 中
中
B. 放电时,![]() 极发生的电极反应为
极发生的电极反应为![]()
C. 放电时负极反应为:![]()
D. 充电时,若转移![]() ,石墨烯电极增重7g
,石墨烯电极增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A 是由两种元素组成的化合物,质量比为 7:8,在真空中加热分解,生成 B、C。E 是常见的液体,C 和E 高温下能发生反应。F 为日常生活中常见的化合物,E、F 之间的反应常用于工业生产,I 为黄绿色气体单质。

(1)写出 A 的化学式:____
(2)写出 K 的电子式:______
(3)写出 C 和 E 高温下能发生反应的方程式:______
(4)写出 D 和 L 发生反应的离子方程式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅和二氧化碳的说法中错误的是( )
A. 与二氧化碳分子相似, 1个硅原子和2个氧原子构成1个二氧化硅分子
B. 通常状况下,二氧化碳为气态,二氧化硅为固体
C. 二氧化硅和二氧化碳都能与氧化钙反应生成盐
D. 二氧化硅和二氧化碳都能与氢氧化钠溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是( )

A. B点的横坐标a=12.5
B. C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C. D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D. 曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是
A. c1 : c2=1 : 3 B. 平衡时,3υY (正) =2υZ (逆)
C. X、Y的转化率不相等 D. c1的取值范围为0.06<c1<0.16 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)______c(CH3COO-)(填“>”、“=”或“<”,下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)
(3)常温下将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)________0.2 mol·L-1 HCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”,下同)
(4)常温下若将0.2 mol·L-1MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度________MCl的水解程度。
(5)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH________。(填“>7”、“<7”或“无法确定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿
是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿![]() 主要成分
主要成分![]() ,还有
,还有![]() 、
、![]() 、
、![]() 等
等![]() 作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程既脱除燃煤尾气中的![]() ,又制得
,又制得![]() 反应条件已经省略
反应条件已经省略![]() 。
。
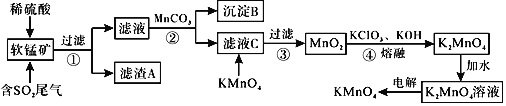
已知:![]() ,
,![]() 回答下列问题:
回答下列问题:
![]() 滤渣A的成分是
滤渣A的成分是![]() 写化学式
写化学式![]() ______。
______。
![]() 析出沉淀B时,首先析出的物质是
析出沉淀B时,首先析出的物质是![]() 写化学式
写化学式![]() ______。
______。
![]() 步骤2中加入
步骤2中加入![]() 的作用为______。
的作用为______。
![]() 滤液C中加入
滤液C中加入![]() 时发生反应的离子方程式是______。
时发生反应的离子方程式是______。
![]() 完成步骤4中反应的化学方程式______
完成步骤4中反应的化学方程式______![]() ______
______![]() ______
______![]() ______
______
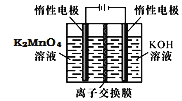
![]() 电解制备
电解制备![]() 的装置如图所示。电解液中最好选择______离子交换膜
的装置如图所示。电解液中最好选择______离子交换膜![]() 填“阳”或“阴”
填“阳”或“阴”![]() 。电解时,阳极的电极反应式为______。
。电解时,阳极的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com