
【题目】对于①NaHCO3②Na2CO3③CH3COOH④CH3COONa四种溶液物质的量浓度均为0.01mol/L,下列说法正确的是()
A.①中加入NaOH固体,![]() 增大
增大
B.②的离子浓度为:c(Na+)>c(OH-)>c(CO32-)>c(H+)
C.③溶液中加入等体积的水稀释,溶液中所有离子浓度都减小
D.②和④等体积混合:c(Na+)>c(CH3COO-)+2c(CO32-)+c(HCO3-)
【答案】D
【解析】
A.①中加入NaOH固体与碳酸氢钠反应生成碳酸钠和水,因此![]() 减小,A错误;
减小,A错误;
B.对于②Na2CO3溶液,碳酸根水解溶液显碱性,但水解程度小,因此c(OH-)<c(CO32-),B错误;
C.对于③CH3COOH,存在电离平衡:CH3COOH![]() CH3COO-+H+,当向其中加入等体积的水稀释,电离平衡正向移动,使n(H+)增大,但c(H+)减小,水的离子积常数不变,则溶液c(OH-)增大,C错误;
CH3COO-+H+,当向其中加入等体积的水稀释,电离平衡正向移动,使n(H+)增大,但c(H+)减小,水的离子积常数不变,则溶液c(OH-)增大,C错误;
D.②和④等体积混合溶液显碱性,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)+2c(CO32-)+c(HCO3-),c(H+)<c(OH-),所以c(Na+)>c(CH3COO-)+2c(CO32-)+c(HCO3-),D正确。
答案选D。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】根据海水综合利用的工业流程图,判断下列说法正确的是

A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.过程③中可以选择氯气作氧化剂
D.第④步反应的离子方程式为:Br2+SO2+2H2O=2H++SO42-+2HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下,下列说法错误的是( )
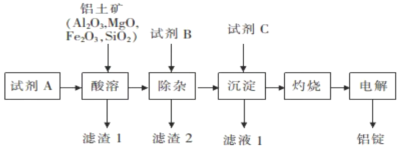
已知:滤渣2主要成分是氢氧化铁、氢氧化镁,B的焰色呈黄色。
A.试剂A可以是稀硫酸或盐酸B.加入试剂B除去![]() 、
、![]()
C.滤渣1的主要成分是![]() D.电解氯化铝也可以制取铝
D.电解氯化铝也可以制取铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
D.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后产生1.16g白色沉淀,在所得的浊液中逐滴加入1 molL-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示。
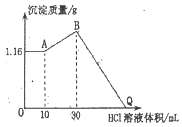
请回答下列问题:
(1)B点的沉淀物的化学式为_____
(2)写出混合物溶于水时发生反应的离子方程式_____
(3)原混合物中MgCl2的物质的量为_____
(4)原固体混合物中NaOH的质量为_____
(5)Q点加入HCl溶液的体积为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2(g)的平衡转化率如表所示。
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.SO2的平衡转化率:α1>α2=α3
C.容器中SO3的物质的量浓度:丙>甲=丁
D.该温度下,甲和乙中反应的平衡常数K均为400
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com