
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2(g)的平衡转化率如表所示。
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.SO2的平衡转化率:α1>α2=α3
C.容器中SO3的物质的量浓度:丙>甲=丁
D.该温度下,甲和乙中反应的平衡常数K均为400
【答案】D
【解析】
A.温度相同,平衡常数相等,则甲、乙中反应的平衡常数相等,故A错误;
B.由甲、乙可知,氧气的浓度相同,增大二氧化硫的浓度会促进氧气的转化,二氧化硫转化率减小,丙和丁达到的是相同的平衡状态,乙、丙相比,丙实验增大了氧气物质的量,氧气的转化率减小,二氧化硫转化率增大;则二氧化硫转化率,α1<α2=α3,故B错误
C.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中SO2转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,丙体积为2L,丁体积为1L,起始量分别为0.8,0.48;0.40,0.24,丙和丁达到的平衡相同,三氧化硫浓度相同,丙=丁>甲,故C错误;
D. 2SO2(g)+O2(g)2SO3(g)
开始(mol) 0.4 0.24 0
转化(mol) 0.32 0.16 0.32
平衡(mol) 0.08 0.08 0.32
平衡浓度0.04 0.04 0.16
所以该温度下,平衡常数K=![]() =400,故D正确;
=400,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】对于①NaHCO3②Na2CO3③CH3COOH④CH3COONa四种溶液物质的量浓度均为0.01mol/L,下列说法正确的是()
A.①中加入NaOH固体,![]() 增大
增大
B.②的离子浓度为:c(Na+)>c(OH-)>c(CO32-)>c(H+)
C.③溶液中加入等体积的水稀释,溶液中所有离子浓度都减小
D.②和④等体积混合:c(Na+)>c(CH3COO-)+2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]
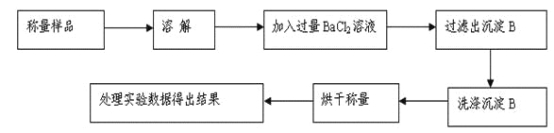
(1)实验时,过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为_____________。
(2)洗涤沉淀B的操作是___________________________________________________。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
方案Ⅱ.乙组同学的主要实验流程图如下:
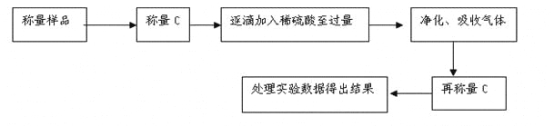
按如下左图所示装置进行实验:
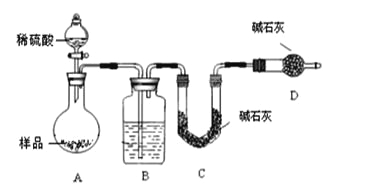
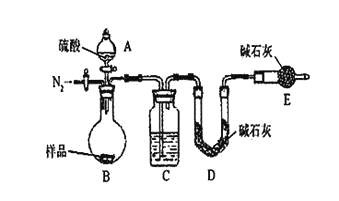
(4)该实验中装置B盛放的物质是_____________________,分液漏斗中__________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中干燥管C在充分吸收气体前后的质量差____________________。(填“越大”、“越小”或“不变化”)
②D装置的作用是_________________________。
(6)有同学认为为了减少实验误差,在反应前后都要通入N2(如上右图),反应后通入N2的目的是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c,d均是热和电的良导体。下列说法不正确的是
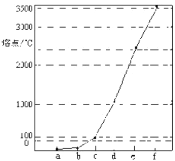
A.e、f单质晶体熔化时克服的是共价键
B.d单质对应元素原子的电子排布式:1s22s22p63s23p2
C.b元素形成的气态氢化物易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种正投入生产的大型蓄电系统,放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A.放电时,负极反应为3NaBr—2e—=NaBr3+2Na+
B.充电时,阳极反应为2Na2S2—2e—=Na2S4+2Na+
C.充电时,Na+经过离子交换膜,由b池移向a池
D.用该电池电解饱和食盐水,产生2.24LH2(标况下)时,b池生成17.40gNa2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)在医药和染料生产中有广泛应用。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:
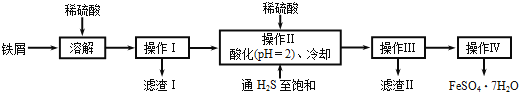
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是__;通入硫化氢至饱和的目的是:①除去操作I所得溶液中含有的Sn2+等杂质离子;②___。
(2)操作Ⅳ的顺序依次为:___、冷却结晶、___。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.0100molL-1KMnO4溶液滴定至终点,消耗KMnO4,溶液体积的平均值为20.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)则上述样品中FeSO47H2O的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制3.6 mol/L的H2SO4溶液80 mL,探究硫酸的性质。实验室有两种不同浓度的硫酸可供选用:① 25%的硫酸(ρ=1.18 g/mL);②98%的硫酸 (ρ=1.8 g/mL)。请回答下列问题:
(1)配制该硫酸溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外还有________;
(2)本实验需量取所选用硫酸的体积为____________________mL;
(3)下列操作会使得所配硫酸溶液浓度偏低的是____________
a.量取硫酸溶液的量筒未用蒸馏水洗涤
b.硫酸稀释后立即转移至容量瓶中
c.转移的时候不小心有少许洒到实验台上
d.定容摇匀时,液面下降又加水
e.定容时仰视刻度线
(4)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。试回答:如何证明溶液中的硫酸根离子沉淀完全?__________________________________;
(5)将100mL标号为②的浓硫酸与水(密度为1g/ml)混合,其质量分数为49﹪,则水的体
积________100mL(填“大于”、“小于”、“等于”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几稱烃的分子球棍模型,据此回答下列问题:
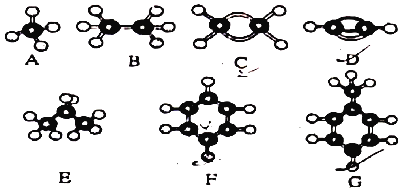
(1)能够发生加成反应的烃有_____(填数字)种;
(2)一卤代物种类最多的是_____ (填对应字母):
(3)写出一种区别F和G的方法(包括试剂和实验现象)_____
(4)写出F发生溴代反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com