
【题目】A~G是几稱烃的分子球棍模型,据此回答下列问题:
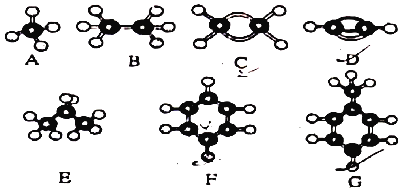
(1)能够发生加成反应的烃有_____(填数字)种;
(2)一卤代物种类最多的是_____ (填对应字母):
(3)写出一种区别F和G的方法(包括试剂和实验现象)_____
(4)写出F发生溴代反应的化学方程式_____。
【答案】4 G 取样,分别加入酸性高锰酸钾溶液,使高锰酸钾溶液褪色的是甲苯,不能使高锰酸钾溶液褪色的是苯 C6H6+Br2![]() C6H5Br+HBr
C6H5Br+HBr
【解析】
根据有机物的球棍模型分析有机物的种类;根据有机物的结构分析有机物的性质,书写相关反应方程式;运用等效氢法分析同分异构体的数目。
由结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯。
(1)能够发生加成反应的烃有乙烯、乙炔、苯和甲苯4种,故答案为:4;
(2)甲烷、乙烷、乙烯、乙炔、苯的一卤代物种类均为1种,丙烷的一卤代物两种,甲苯的一卤代物种类最多、有4种,故答案为:G;
(3)甲苯能与高锰酸钾溶液发生氧化反应,使高锰酸钾溶液褪色,苯与高锰酸钾溶液不反应,可用于区别甲苯和苯,故答案为:取样,分别加入酸性高锰酸钾溶液,使高锰酸钾溶液褪色的是甲苯,不能使高锰酸钾溶液褪色的是苯;
(4)在Fe催化作用下,苯与液溴发生取代反应生成溴苯,化学方程式为C6H6+Br2![]() C6H5Br+HBr,故答案为:C6H6+Br2
C6H5Br+HBr,故答案为:C6H6+Br2![]() C6H5Br+HBr。
C6H5Br+HBr。


科目:高中化学 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2(g)的平衡转化率如表所示。
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.SO2的平衡转化率:α1>α2=α3
C.容器中SO3的物质的量浓度:丙>甲=丁
D.该温度下,甲和乙中反应的平衡常数K均为400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数;______________
(2)混合后溶液的物质的量浓度;(保留到小数点后一位,下同)___________
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯与液溴制取溴苯:
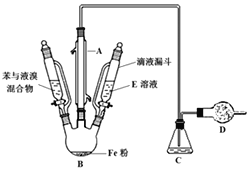
(1)装置A的名称是_______________。
(2)制取溴苯的化学反应方程式_____________。
(3)反应时,装置B中出现的现象有___________。
(4)冷凝水顺序_______(A.上进下出 B.下进上出),长导管的作用____________,请解释装置C中导管位置为什么不能伸入液面以下____________。
(5)装置D的作用是 __________。
(6)反应结束后,将滴液漏斗中的溶液E加入到烧瓶B中,充分振荡后可除去溴苯中的溴,溶液E是 _______________;液体经过分液,所得的溴苯中还含有少量苯,如何进行分离?________(备选答案:过滤/萃取/蒸馏/重结晶)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
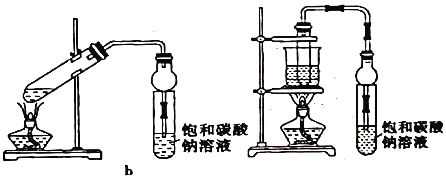
完成下列填空:
(1)实验时,试剂加入顺序是_____;通常加入过量的乙醇,原因是_____。
(2)加入数滴浓酸即能起催化作用,实际用量多于催化量,因为浓H2SO4能吸收生成的水,但浓硫酸用量又不能过多,原因是_____
(3)饱和Na2CO3溶液的作用是_____,_____。
(4)写出乙酸乙酯在NaOH溶液中加热的化学方程式_____。
(5)若用b装置制备乙酸乙酯其缺点_____。
(6)由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,分离乙酸乙与该杂质的方法是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
 。
。
I、制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5g,放入250mL三颈烧瓶中,加入10滴左右1.0mol·L-1H2SO4溶液和15mL蒸馏水加热溶解;
②加入25mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③待黄色晶体FeC2O4·2H2O沉淀后倾析,洗涤,加入约20mL蒸馏水搅拌并温热5min,静置,弃去上层清液,即得黄色草酸亚铁晶体。
回答下列问题:
(1)仪器B的作用是___;
(2)硫酸亚铁铵晶体用硫酸溶解的原因是___;
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,在酸性条件下可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式:__;
II、探究草酸亚铁的纯度:
①准确称取mg草酸亚铁固体样品(含有草酸铵杂质),溶于25mL2mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100mL容量瓶配成100.00mL溶液;
②用___滴定管(填“酸式”、“碱式”)取上述溶液20.00mL,用KMnO4标准溶液(浓度为cmol·L-1)滴定三次,平均消耗V1mL;
③在②反应后的溶液中加入适量锌粉和2mL2 mol·L-1H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3mL2mol·L-1 H2SO4溶液,继续用KMnO4标准溶液(浓度为cmol·L-1)滴定至终点,共平行测定三次,平均消耗V2mL。
回答下列问题:
(4)在②中溶液中发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,还有另一氧化还原反应,写出其离子方程式__。
(5)加入适量锌粉的目的是___;步骤③中检验其中微量的Fe3+的试剂是__(用化学式表示)溶液。步骤④用KMnO4标准溶液滴定至终点的现象是___。
(6)计算mg固体样品的纯度为__(用含c、V2的式子表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三份浓度均为0.1 mol/L,体积均为1 L 的CH3COONa 溶液中分别加入NH4Cl 固体、CH3COONH4固体、HCl 气体后所得溶液pH 变化曲线如图(溶液体积变化忽略不计)下列说法不正确的是
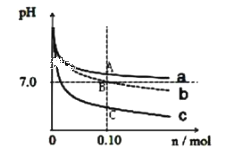
A.曲线 a、b、c 分别代表加入 CH3COONH4、NH4Cl、HCl
B.由图可知 Ka(CH3COOH)=Kb(NH3﹒H2O)=1×10-7
C.A点处 c(CH3COO-)>c(Na+)> c(NH4+)> c(OH-)> c(H+)
D.C点处 c(CH3COO-)+c(Cl-)+c(OH-)>0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
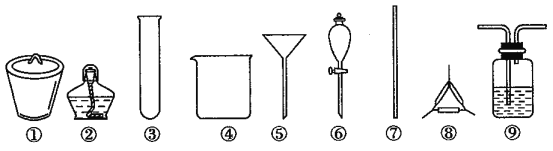
A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com