
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
 。
。
I、制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5g,放入250mL三颈烧瓶中,加入10滴左右1.0mol·L-1H2SO4溶液和15mL蒸馏水加热溶解;
②加入25mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③待黄色晶体FeC2O4·2H2O沉淀后倾析,洗涤,加入约20mL蒸馏水搅拌并温热5min,静置,弃去上层清液,即得黄色草酸亚铁晶体。
回答下列问题:
(1)仪器B的作用是___;
(2)硫酸亚铁铵晶体用硫酸溶解的原因是___;
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,在酸性条件下可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式:__;
II、探究草酸亚铁的纯度:
①准确称取mg草酸亚铁固体样品(含有草酸铵杂质),溶于25mL2mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100mL容量瓶配成100.00mL溶液;
②用___滴定管(填“酸式”、“碱式”)取上述溶液20.00mL,用KMnO4标准溶液(浓度为cmol·L-1)滴定三次,平均消耗V1mL;
③在②反应后的溶液中加入适量锌粉和2mL2 mol·L-1H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3mL2mol·L-1 H2SO4溶液,继续用KMnO4标准溶液(浓度为cmol·L-1)滴定至终点,共平行测定三次,平均消耗V2mL。
回答下列问题:
(4)在②中溶液中发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,还有另一氧化还原反应,写出其离子方程式__。
(5)加入适量锌粉的目的是___;步骤③中检验其中微量的Fe3+的试剂是__(用化学式表示)溶液。步骤④用KMnO4标准溶液滴定至终点的现象是___。
(6)计算mg固体样品的纯度为__(用含c、V2的式子表示,不必化简)。
【答案】冷凝回流 抑制Fe2+的水解 2NH3OH++2Fe3+=2Fe2++N2↑+2H2O+4H+ 酸式 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 将Fe3+还原为Fe2+ KSCN 最后1滴标准溶液加入后,锥形瓶中的溶液颜色由浅绿色变为浅紫红色,且半分钟内不褪色 ![]() ×100%
×100%
【解析】
I、(1)B为冷凝管,作用即冷凝回流;
(2)硫酸可抑制Fe2+的水解;
(3)羟胺可将Fe3+还原为Fe2+;
II、②样品溶液有酸性,用酸式滴定管量取;
(4)另一反应为高锰酸钾将草酸氧化为CO2的反应;
(5)锌粉可将Fe3+还原为Fe2+,检验Fe3+用KSCN 溶液,出现血红色,滴定至终点时,最后1滴标准溶液加入后,锥形瓶中的溶液颜色由浅绿色变为浅紫红色;
(6)通过方程式导出关系式:KMnO4~5FeC2O4·2H2O,代入数据进行计算。
I、(1)由题意可知,仪器B的作用是冷凝回流;
(2)用硫酸溶解硫酸亚铁铵晶体可抑制Fe2+的水解;
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,在酸性条件下可用羟胺去除亚铁盐中的Fe3+,离子方程式为2NH3OH++2Fe3+=2Fe2++N2↑+2H2O+4H+;
II、②草酸亚铁固体样品(含有草酸铵杂质),溶于25mL2mol·L-1H2SO4溶液中配制成样品溶液,所以应用酸式滴定管;
(4)在②中溶液中发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,草酸亚铁和草酸铵和硫酸反应后生成草酸,也能被高锰酸钾溶液氧化,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(5)加入适量锌粉的目的是将Fe3+还原为Fe2+,步骤③中检验其中微量的Fe3+的试剂是KSCN 溶液,步骤④用KMnO4标准溶液滴定至终点的现象是最后1滴标准溶液加入后,锥形瓶中的溶液颜色由浅绿色变为浅紫红色,且半分钟内不褪色;
(6)由关系式KMnO4 ~ 5 FeC2O4·2H2O
1 5×180
c×V2×10-3 ×![]() m
m
解得m=4.5cV2,所以mg固体样品的纯度为![]() ×100%。
×100%。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]
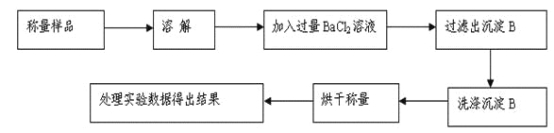
(1)实验时,过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为_____________。
(2)洗涤沉淀B的操作是___________________________________________________。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
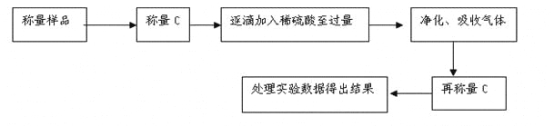
方案Ⅱ.乙组同学的主要实验流程图如下:
按如下左图所示装置进行实验:
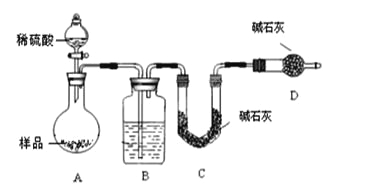
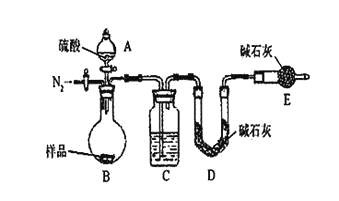
(4)该实验中装置B盛放的物质是_____________________,分液漏斗中__________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中干燥管C在充分吸收气体前后的质量差____________________。(填“越大”、“越小”或“不变化”)
②D装置的作用是_________________________。
(6)有同学认为为了减少实验误差,在反应前后都要通入N2(如上右图),反应后通入N2的目的是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制3.6 mol/L的H2SO4溶液80 mL,探究硫酸的性质。实验室有两种不同浓度的硫酸可供选用:① 25%的硫酸(ρ=1.18 g/mL);②98%的硫酸 (ρ=1.8 g/mL)。请回答下列问题:
(1)配制该硫酸溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外还有________;
(2)本实验需量取所选用硫酸的体积为____________________mL;
(3)下列操作会使得所配硫酸溶液浓度偏低的是____________
a.量取硫酸溶液的量筒未用蒸馏水洗涤
b.硫酸稀释后立即转移至容量瓶中
c.转移的时候不小心有少许洒到实验台上
d.定容摇匀时,液面下降又加水
e.定容时仰视刻度线
(4)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。试回答:如何证明溶液中的硫酸根离子沉淀完全?__________________________________;
(5)将100mL标号为②的浓硫酸与水(密度为1g/ml)混合,其质量分数为49﹪,则水的体
积________100mL(填“大于”、“小于”、“等于”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几稱烃的分子球棍模型,据此回答下列问题:
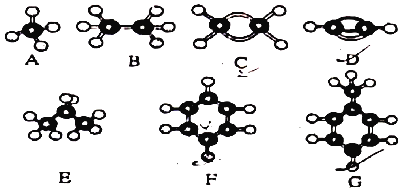
(1)能够发生加成反应的烃有_____(填数字)种;
(2)一卤代物种类最多的是_____ (填对应字母):
(3)写出一种区别F和G的方法(包括试剂和实验现象)_____
(4)写出F发生溴代反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O是一种浅绿色晶体,在水中的溶解度较小,不溶于乙醇。某实验小组利用镀锌铁片来制备硫酸亚铁铵的过程如下:
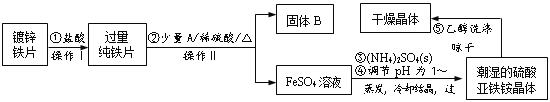
(1)加入盐酸的目的是___。
(2)A物质可以是___(选填序号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是___。
(3)操作Ⅱ的名称为___。
(4)采用晾干而不用加热烘干晶体的原因是___。
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+。写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵是分析化学中重要的试剂,某实验小组制备和探究其分解产物的实验如下:I.制备硫酸亚铁铵
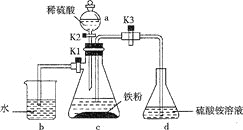
(1)仪器a的名称是__。
(2)将过量铁粉置于c中,加蒸馏水于b中,硫酸铵溶液于d中,按图连接好装置,打开K1、K2,关闭K3.使用铁粉“过量”的原因是___。
(3)关闭K1和K2,打开K3,c中浅绿色溶液流入d,其原因是___;d中析出沉淀,用化学方程式解释:___。
Ⅱ.探究硫酸亚铁铵的部分分解产物
假设气体产物仅有NH3、SO2、SO3(g)和H2O(g),设计如下所需装置进行实验;
已知:CaCl2+8NH3=CaCl2·8NH3
A.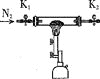 B.
B. C.
C. D.
D. E.
E.![]()
①将I中制备的沉淀装入A,装置连接顺序为___,打开K1和K2,缓缓通入N2,一段时间后,关闭K1开始加热,实验后反应管中残留固体为红色粉末;
②B、D中有气泡冒出,还可观察到的现象分别为__,
③硫酸亚铁铵的分解方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。如下图所示装置是用燃烧法确定有机物化学式常用的装置,这种方法是电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
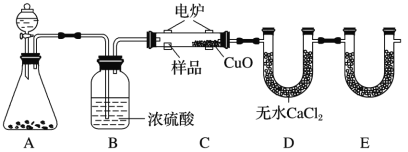
回答下列问题:
(1)A装置分液漏斗中盛放的物质是_______,写出有关反应的化学方程式:________。
(2)C装置(燃烧管)中CuO的作用是__________。
(3)写出E装置中所盛放试剂的名称:________,它的作用是__________。
(4)若将B装置去掉会对实验造成什么影响?________。
(5)若准确称取 18.0g样品(只含 C、H、O 三种元素中的两种或三种),经充分燃烧后,E管质量增加26.4g,D 管质量增加 10.8g,则该有机物的最简式为__________。
(6)要确定该有机物的分子式,还需要测定______,目前最精确、最快捷的测定方法是________。称取A物质18.0g,升温使其汽化,测其密 度是相同条件下H2的45倍。试通过计算填空:A的相对分子质量为______。
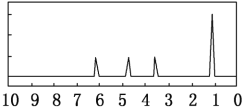
(7)另取A18.0g与足量的NaHCO3粉末反应,生成0.2mol CO2,若与足量钠反应则生成 0.2molH2。若核磁共振氢谱如下图,则该分子可能为__________(填结构简式),其中所含官能团的名称______。确定该有机物的物理方法是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com