
【题目】硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O是一种浅绿色晶体,在水中的溶解度较小,不溶于乙醇。某实验小组利用镀锌铁片来制备硫酸亚铁铵的过程如下:
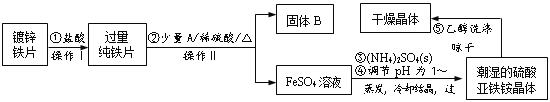
(1)加入盐酸的目的是___。
(2)A物质可以是___(选填序号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是___。
(3)操作Ⅱ的名称为___。
(4)采用晾干而不用加热烘干晶体的原因是___。
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+。写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式___。
【答案】为了除去锌镀层 bd 加快铁与稀硫酸的反应速率 过滤 避免加热过程中晶体受热分解失去结晶水或被空气氧化 6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O
【解析】
(1)盐酸可以除去锌镀层;
(2)加入的物质与稀硫酸反应后的物质能与铁反应且不引入新的杂质;
(3)分离固体和溶液用过滤的方法;
(4)硫酸亚铁铵晶体受热易分解且易被氧化;
(5)K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+,亚铁离子被氧化生成铁离子。
(1)加入盐酸是为了除去锌镀层;
(2)加入的物质与稀硫酸反应后的物质能与铁反应且不引进新的杂质,ac能引进新的杂质离子,bd不能引进新的杂质离子,故选bd;加入少量A,A中含有铜离子,铜离子和铁反应生成铜,铜、铁和酸能构成原电池,从而加快铁与稀硫酸的反应速率;
(3)分离固体和溶液的方法是过滤;
(4)如果采用加热的方法制取硫酸亚铁铵,加热过程中,硫酸亚铁铵易失水,且亚铁离子易被氧气氧化,从而得不到硫酸亚铁铵晶体;
(5)K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+,亚铁离子被氧化生成铁离子,离子反应方程式为:6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O。


科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法不正确的是
A.5.5g超重水(T2O)中含有的中子数目为3NA
B.常温常压下,44gCO2与足量过氧化钠反应转移电子的数目为NA
C.常温常压下,42gC2H4和C4H8混合气体中含有氢原子的数目为6NA
D.0.1L0.5mol·L-1CH3COOH溶液中含有H+数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数;______________
(2)混合后溶液的物质的量浓度;(保留到小数点后一位,下同)___________
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
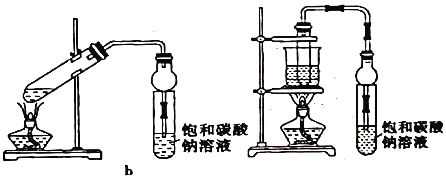
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
完成下列填空:
(1)实验时,试剂加入顺序是_____;通常加入过量的乙醇,原因是_____。
(2)加入数滴浓酸即能起催化作用,实际用量多于催化量,因为浓H2SO4能吸收生成的水,但浓硫酸用量又不能过多,原因是_____
(3)饱和Na2CO3溶液的作用是_____,_____。
(4)写出乙酸乙酯在NaOH溶液中加热的化学方程式_____。
(5)若用b装置制备乙酸乙酯其缺点_____。
(6)由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,分离乙酸乙与该杂质的方法是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
 。
。
I、制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5g,放入250mL三颈烧瓶中,加入10滴左右1.0mol·L-1H2SO4溶液和15mL蒸馏水加热溶解;
②加入25mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③待黄色晶体FeC2O4·2H2O沉淀后倾析,洗涤,加入约20mL蒸馏水搅拌并温热5min,静置,弃去上层清液,即得黄色草酸亚铁晶体。
回答下列问题:
(1)仪器B的作用是___;
(2)硫酸亚铁铵晶体用硫酸溶解的原因是___;
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,在酸性条件下可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式:__;
II、探究草酸亚铁的纯度:
①准确称取mg草酸亚铁固体样品(含有草酸铵杂质),溶于25mL2mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100mL容量瓶配成100.00mL溶液;
②用___滴定管(填“酸式”、“碱式”)取上述溶液20.00mL,用KMnO4标准溶液(浓度为cmol·L-1)滴定三次,平均消耗V1mL;
③在②反应后的溶液中加入适量锌粉和2mL2 mol·L-1H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3mL2mol·L-1 H2SO4溶液,继续用KMnO4标准溶液(浓度为cmol·L-1)滴定至终点,共平行测定三次,平均消耗V2mL。
回答下列问题:
(4)在②中溶液中发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,还有另一氧化还原反应,写出其离子方程式__。
(5)加入适量锌粉的目的是___;步骤③中检验其中微量的Fe3+的试剂是__(用化学式表示)溶液。步骤④用KMnO4标准溶液滴定至终点的现象是___。
(6)计算mg固体样品的纯度为__(用含c、V2的式子表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的量和摩尔质量的叙述,正确的是 ( )
A. 水的摩尔质量是18 g
B. 0.012 kg 12C中约含有6.02![]() 1023个碳原子
1023个碳原子
C. 1 mol水中含有2 mol氢和1 mol氧
D. 1 mol任何物质都含有6.02![]() 1023个分子
1023个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三份浓度均为0.1 mol/L,体积均为1 L 的CH3COONa 溶液中分别加入NH4Cl 固体、CH3COONH4固体、HCl 气体后所得溶液pH 变化曲线如图(溶液体积变化忽略不计)下列说法不正确的是
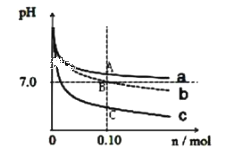
A.曲线 a、b、c 分别代表加入 CH3COONH4、NH4Cl、HCl
B.由图可知 Ka(CH3COOH)=Kb(NH3﹒H2O)=1×10-7
C.A点处 c(CH3COO-)>c(Na+)> c(NH4+)> c(OH-)> c(H+)
D.C点处 c(CH3COO-)+c(Cl-)+c(OH-)>0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的两种弱酸HA和HB分别加水稀释,pH随溶液体积变化的曲线如图所示。下列判断正确的是( )
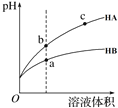
A.酸性:HB> HA
B.结合H+的能力:B->A-
C.导电能力:c > b
D.与氢氧化钠完全反应时,消耗氢氧化钠体积Va<Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com