
【题目】硫酸亚铁铵是分析化学中重要的试剂,某实验小组制备和探究其分解产物的实验如下:I.制备硫酸亚铁铵
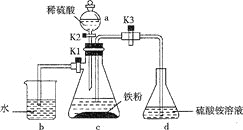
(1)仪器a的名称是__。
(2)将过量铁粉置于c中,加蒸馏水于b中,硫酸铵溶液于d中,按图连接好装置,打开K1、K2,关闭K3.使用铁粉“过量”的原因是___。
(3)关闭K1和K2,打开K3,c中浅绿色溶液流入d,其原因是___;d中析出沉淀,用化学方程式解释:___。
Ⅱ.探究硫酸亚铁铵的部分分解产物
假设气体产物仅有NH3、SO2、SO3(g)和H2O(g),设计如下所需装置进行实验;
已知:CaCl2+8NH3=CaCl2·8NH3
A.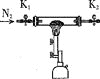 B.
B. C.
C.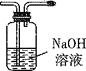 D.
D.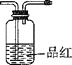 E.
E.![]()
①将I中制备的沉淀装入A,装置连接顺序为___,打开K1和K2,缓缓通入N2,一段时间后,关闭K1开始加热,实验后反应管中残留固体为红色粉末;
②B、D中有气泡冒出,还可观察到的现象分别为__,
③硫酸亚铁铵的分解方程式:___。
【答案】分液漏斗 确保生成的硫酸亚铁不会被氧化 关闭K1和K2,随着c中气体量的增加,将c中溶液压入d中 FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)2↓ EBDC 产生白色沉淀、品红溶液褪色 2(NH4)2Fe(SO4)2![]() 4NH3↑+Fe2O3+SO2↑+3SO3↑+2H2O↑
4NH3↑+Fe2O3+SO2↑+3SO3↑+2H2O↑
【解析】
I.(1)根据装置图书写仪器a的名称;
(2)铁粉过量,可保证生成的气体将锥形瓶中空气排出,确保硫酸亚铁不会被氧化;
(3)关闭K1和K2,随着c中气体量的增加,可将c中溶液压入d中, FeSO4溶液与(NH4)2SO4溶液混合后生成(NH4)2Fe(SO4)2,常温下(NH4)2Fe(SO4)2溶解度较小,以沉淀形式析出;
Ⅱ.①硫酸亚铁铵受热分解后生成的气体有NH3、SO2、SO3(g)和H2O(g),先用CaCl2吸收气体产物中的NH3和H2O,再用BaCl2溶液鉴定并吸收SO3,剩余的SO2能使品红溶液褪色,最后用氢氧化钠溶液吸收;
②B中SO3与氯化钡反应生成白色沉淀,D中SO2使品红溶液褪色;
③硫酸亚铁铵受热分解生成氨气、水、SO2、SO3和Fe2O3。
I.(1)根据装置图可得a的名称为分液漏斗;
(2)过量的铁粉能确保生成的硫酸亚铁不会被氧化,还能够排出锥形瓶中的氧气;
(3)关闭K1和K2,随着c中气体量的增加,可将c中溶液压入d中,发生反应;FeSO4溶液与(NH4)2SO4溶液混合后生成(NH4)2Fe(SO4)2,常温下(NH4)2Fe(SO4)2溶解度较小,以沉淀形式析出,故反应方程式为:FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)2↓;
Ⅱ.①固体CaCl2的作用是吸收气体产物中的NH3和H2O,BaCl2溶液鉴定并吸收SO3,品红鉴定SO2,最后NaOH溶液的作用是处理尾气,所以装置的连接顺序是EBDC;
②B、D中的现象分别是产生白色沉淀、品红溶液褪色;
③根据实验后反应管中残留固体为红色粉末,可推测固体产物为Fe2O3,由题干知气体产物有NH3、SO2、SO3(g)和H2O(g),故化学方程式为2(NH4)2Fe(SO4)2![]() 4NH3↑+Fe2O3+SO2↑+3SO3↑+2H2O↑。
4NH3↑+Fe2O3+SO2↑+3SO3↑+2H2O↑。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
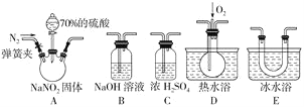
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯与液溴制取溴苯:
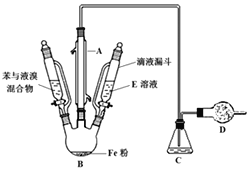
(1)装置A的名称是_______________。
(2)制取溴苯的化学反应方程式_____________。
(3)反应时,装置B中出现的现象有___________。
(4)冷凝水顺序_______(A.上进下出 B.下进上出),长导管的作用____________,请解释装置C中导管位置为什么不能伸入液面以下____________。
(5)装置D的作用是 __________。
(6)反应结束后,将滴液漏斗中的溶液E加入到烧瓶B中,充分振荡后可除去溴苯中的溴,溶液E是 _______________;液体经过分液,所得的溴苯中还含有少量苯,如何进行分离?________(备选答案:过滤/萃取/蒸馏/重结晶)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
 。
。
I、制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5g,放入250mL三颈烧瓶中,加入10滴左右1.0mol·L-1H2SO4溶液和15mL蒸馏水加热溶解;
②加入25mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③待黄色晶体FeC2O4·2H2O沉淀后倾析,洗涤,加入约20mL蒸馏水搅拌并温热5min,静置,弃去上层清液,即得黄色草酸亚铁晶体。
回答下列问题:
(1)仪器B的作用是___;
(2)硫酸亚铁铵晶体用硫酸溶解的原因是___;
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,在酸性条件下可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式:__;
II、探究草酸亚铁的纯度:
①准确称取mg草酸亚铁固体样品(含有草酸铵杂质),溶于25mL2mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100mL容量瓶配成100.00mL溶液;
②用___滴定管(填“酸式”、“碱式”)取上述溶液20.00mL,用KMnO4标准溶液(浓度为cmol·L-1)滴定三次,平均消耗V1mL;
③在②反应后的溶液中加入适量锌粉和2mL2 mol·L-1H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3mL2mol·L-1 H2SO4溶液,继续用KMnO4标准溶液(浓度为cmol·L-1)滴定至终点,共平行测定三次,平均消耗V2mL。
回答下列问题:
(4)在②中溶液中发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,还有另一氧化还原反应,写出其离子方程式__。
(5)加入适量锌粉的目的是___;步骤③中检验其中微量的Fe3+的试剂是__(用化学式表示)溶液。步骤④用KMnO4标准溶液滴定至终点的现象是___。
(6)计算mg固体样品的纯度为__(用含c、V2的式子表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1 mol/L的是( )
A.将40 g NaOH固体溶解于1 L水中
B.将22.4 L氯化氢气体溶于水配成1 L溶液
C.将1 L 10 mol/L的浓盐酸与9 L水混合
D.10 g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三份浓度均为0.1 mol/L,体积均为1 L 的CH3COONa 溶液中分别加入NH4Cl 固体、CH3COONH4固体、HCl 气体后所得溶液pH 变化曲线如图(溶液体积变化忽略不计)下列说法不正确的是
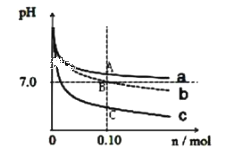
A.曲线 a、b、c 分别代表加入 CH3COONH4、NH4Cl、HCl
B.由图可知 Ka(CH3COOH)=Kb(NH3﹒H2O)=1×10-7
C.A点处 c(CH3COO-)>c(Na+)> c(NH4+)> c(OH-)> c(H+)
D.C点处 c(CH3COO-)+c(Cl-)+c(OH-)>0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列关于pH=1的CH3COOH溶液和pH=1的HCl溶液的叙述中不正确的是:
A. 两种溶液中溶质的物质的量浓度:CH3COOH>HCl
B. 向CH3COOH溶液中通入HCl(g), ![]() 的值不变
的值不变
C. 均加水稀释100倍,稀释后的pH:HCl>CH3COOH
D. 与相同镁条反应,开始时的速率:HCl>CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业的核心反应是N2(g)+3H2(g) ![]() 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
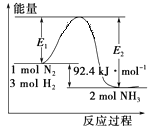
(1)该反应的ΔH=_______kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1 _____(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量_________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:P4(s,白磷)+5O2 (g)= P4O10 (s)ΔH1=-2983.2 kJ/mol 4P(s,红磷)+ 5O2 (g) = P4O10 (s) ΔH2 =-2954kJ/mol,则该温度下白磷转化为红磷的热化学方程式:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法中正确的是( )
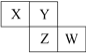
A.W的原子序数不可能是X的原子序数的3倍
B.Z元素可能是金属元素
C.四种元素的原子有可能均能与氢原子形成18电子分子
D.W的气态氢化物的稳定性一定比Y的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com