
【题目】绿矾(FeSO47H2O)在医药和染料生产中有广泛应用。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:
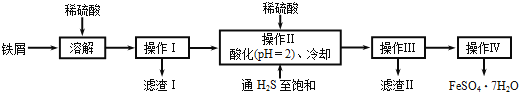
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是__;通入硫化氢至饱和的目的是:①除去操作I所得溶液中含有的Sn2+等杂质离子;②___。
(2)操作Ⅳ的顺序依次为:___、冷却结晶、___。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.0100molL-1KMnO4溶液滴定至终点,消耗KMnO4,溶液体积的平均值为20.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)则上述样品中FeSO47H2O的质量分数为___。
【答案】使Sn2+完全变成SnS沉淀,而Fe2+不沉淀 防止Fe2+的氧化 蒸发浓缩 过滤洗涤 降低洗涤过程中FeSO47H2O的损耗 97.54%
【解析】
根据流程图可知,铁屑加入稀硫酸溶解过滤得到不溶性杂质,滤液用硫酸酸化后调节pH为2,使锡离子完全沉淀,此时Fe2+不沉淀,通入H2S至饱和除去操作I中含有的Sn2+等杂质离子,H2S具有较强的还原性,能防止Fe2+被氧化,过滤可得滤渣Ⅱ为SnS,通过蒸发浓缩,洗涤得到结晶;
(1)根据已知条件可知,在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节pH为2是为了除去杂质Sn2+,通入H2S至饱和,H2S具有较强的还原性,能防止Fe2+被氧化;
(2)操作Ⅳ的目的是从滤液中析出绿矾,利用蒸发浓缩、冷却结晶、洗涤过滤可得晶体;
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,可除去表面的杂质,温度降低,溶解度降低,可减少晶体的损失;
(4)根据滴定实验的反应终点发生的反应进行计算。
(1)已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中通入硫化氢至饱和并用硫酸酸化至pH=2的目的是,在溶液PH=2时使Sn2+完全沉淀,而亚铁离子不沉淀,通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化;
(2)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,冷却结晶析出后过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤洗涤;
(3)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失;
(4)a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL;依据反应方程式进行计算:
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;则250mL溶液中含Fe2+=0.001mol×![]() =0.01mol;FeSO47H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;质量分数=
=0.01mol;FeSO47H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;质量分数=![]() ×100%=97.54%。
×100%=97.54%。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后产生1.16g白色沉淀,在所得的浊液中逐滴加入1 molL-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示。
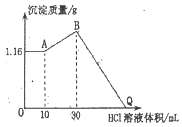
请回答下列问题:
(1)B点的沉淀物的化学式为_____
(2)写出混合物溶于水时发生反应的离子方程式_____
(3)原混合物中MgCl2的物质的量为_____
(4)原固体混合物中NaOH的质量为_____
(5)Q点加入HCl溶液的体积为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法不正确的是
A.5.5g超重水(T2O)中含有的中子数目为3NA
B.常温常压下,44gCO2与足量过氧化钠反应转移电子的数目为NA
C.常温常压下,42gC2H4和C4H8混合气体中含有氢原子的数目为6NA
D.0.1L0.5mol·L-1CH3COOH溶液中含有H+数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
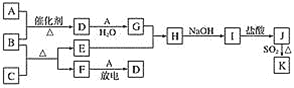
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2(g)的平衡转化率如表所示。
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.SO2的平衡转化率:α1>α2=α3
C.容器中SO3的物质的量浓度:丙>甲=丁
D.该温度下,甲和乙中反应的平衡常数K均为400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾制备流程如图所示,下列有关说法不正确的是( )
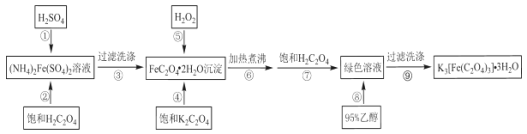
A.在步骤①中加入少量硫酸的目的是防止硫酸亚铁铵的水解,提高草酸亚铁的纯度
B.FeC2O42H2O转化为绿色溶液的离子方程式为:2FeC2O42H2O+H2O2+3C2O42-+H2C2O4=2[Fe(C2O4)3]3-+3H2O
C.在步骤⑥中加热煮沸的目的是为了加快H2O2将亚铁充分氧化为三价铁
D.步骤③与⑨洗涤沉淀的洗涤剂分别可为蒸馏水、无水乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数;______________
(2)混合后溶液的物质的量浓度;(保留到小数点后一位,下同)___________
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
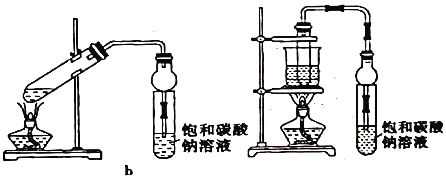
完成下列填空:
(1)实验时,试剂加入顺序是_____;通常加入过量的乙醇,原因是_____。
(2)加入数滴浓酸即能起催化作用,实际用量多于催化量,因为浓H2SO4能吸收生成的水,但浓硫酸用量又不能过多,原因是_____
(3)饱和Na2CO3溶液的作用是_____,_____。
(4)写出乙酸乙酯在NaOH溶液中加热的化学方程式_____。
(5)若用b装置制备乙酸乙酯其缺点_____。
(6)由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,分离乙酸乙与该杂质的方法是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的两种弱酸HA和HB分别加水稀释,pH随溶液体积变化的曲线如图所示。下列判断正确的是( )
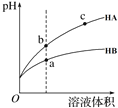
A.酸性:HB> HA
B.结合H+的能力:B->A-
C.导电能力:c > b
D.与氢氧化钠完全反应时,消耗氢氧化钠体积Va<Vb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com