
【题目】常温下,将0.1L0.1mol/L Na2S2O3溶液与一定量的pH=2的硫酸溶液混合,放出VL气体.NA代表阿伏伽德罗常数的值,下列说法正确的足( )
A.pH=2的硫酸溶液含有H+数目为0.01NA
B.该反应释放SO2分子数目为 ![]() NA
NA
C.反应中每摩尔Na2S2O3转移的电子数目为4NA
D.若98gH2SO4溶于水完全电离,其断裂的共价键数目为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高纯硅晶体是信息技术的重要材料。
(1)工业上用石英和焦炭可以制得粗硅。已知反应过程的能量变化如下图


写出用石英和焦炭制取粗硅的热化学方程式______________________________。
(2)某同学设计下列流程制备高纯硅:

①Y的化学式为____________________。
②写出反应I的离子方程式________________________________________。
③写出反应IV的化学方程式________________________________________。
④甲烷分解的温度远远高于硅烷(SiH4),用原子结构解释其原因______________________________。
(3)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。

A.该反应是放热反应
B.横坐标表示的投料比可以是![]()
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是

A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍,工业上用C1O2气体制NaClO2的工艺流程如下:

己知:NaClO2饱和溶液在低于38℃时析出NaC1O2·3H2O,高于38℃时析出NaClO2
下列说法不正确的是
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
C. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) ![]() 3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. Q点时,Y的转化率最大
B. W点X的正反应速率等于M点X的正反应速率
C. 升高温度,平衡常数增大
D. 温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
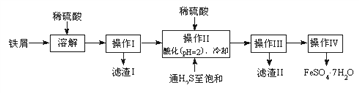
查询资料,得有关物质的数据如下表:
25℃时 | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 |
pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为____________________。
A.KSCN溶液B.NaOH溶液C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是(写两点)___________、____________。
(3)操作IV的顺序依次为________、冷却结晶、过滤。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为_________(填仪器名称)。
②计算上述样品中FeSO47H2O的质量分数为__________。
③上述测定中,若滴定管规格为50mL,则步骤a中称取样品的质量不能超过______g。(保留4位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com