
����Ŀ���ߴ��辧������Ϣ��������Ҫ���ϡ�
��1����ҵ����ʯӢ�ͽ�̿�����Ƶôֹ衣��֪��Ӧ���̵������仯����ͼ


д����ʯӢ�ͽ�̿��ȡ�ֹ���Ȼ�ѧ����ʽ______________________________��
��2��ijͬѧ������������Ʊ��ߴ��裺

��Y�Ļ�ѧʽΪ____________________��
��д����ӦI�����ӷ���ʽ________________________________________��
��д����ӦIV�Ļ�ѧ����ʽ________________________________________��
�ܼ���ֽ���¶�ԶԶ���ڹ��飨SiH4������ԭ�ӽṹ������ԭ��______________________________��
��3�����ֹ�ת�������ȹ��飨SiHCl3������һ����ӦҲ�����Ƶôֹ衣�䷴Ӧ��SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����
Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����

A���÷�Ӧ�Ƿ��ȷ�Ӧ
B���������ʾ��Ͷ�ϱȿ�����![]()
C���÷�Ӧ��ƽ�ⳣ�����¶����߶�����
D��ʵ��������Ϊ���SiHCl3�������ʣ������ʵ�����ѹǿ
���𰸡� SiO2(s)+2C(s)=Si(s)+2CO(g) H=+638.4kJ/mol H2SiO3��H4SiO4 SiO2+2OH-=SiO32-+H2O SiO2+4Mg![]() Mg2Si+2MgO ���ڱ��У�����̼����ͬ���壬ԭ�Ӱ뾶Si����C����Ԫ�صķǽ���������̼Ԫ�أ���������ȶ������ڼ��� BC��
Mg2Si+2MgO ���ڱ��У�����̼����ͬ���壬ԭ�Ӱ뾶Si����C����Ԫ�صķǽ���������̼Ԫ�أ���������ȶ������ڼ��� BC��
����������1�������Ȼ�ѧ��Ӧ����ʽ�ļ��㣬���ݵ�һ��ͼ���Ȼ�ѧ��Ӧ����ʽΪSi(s)��O2(g)=SiO2(s) ��H=��859.4kJ��mol��1�٣��ڶ���ͼ�Ȼ�ѧ��Ӧ����ʽΪ2C(s)��O2(g)=2CO(g) ��H=��221.0kJ��mol��1�ڣ�ʯӢ�ͽ�̿��Ӧ�Ʊ��ֹ�ķ�Ӧ����ʽΪSiO2��2C=2CO��Si������ɢڣ��ٵó���SiO2(s)+2C(s)=Si(s)+2CO(g) H=+638.4kJ/mol����2�����⿼�黯ѧ�������̣���ɰ���к���SiO2����NaOH��Ӧ����Na2SiO3������II��X�м���ϡ���ᣬ����SiO32����2H��=H2SiO3������SiO32����2H����H2O=H4SiO4������Y�Ļ�ѧʽΪH2SiO3��H4SiO4���ڷ�ӦI�����ӷ���ʽΪSiO2��2OH��=SiO32����H2O���۸������̣�����SiO2+4Mg![]() Mg2Si+2MgO���ܼ�����鶼���ڷ��Ӿ��壬C��ԭ�Ӱ뾶С��Si��Ҳ����C��H������Si��H�����̣���̼Ԫ�صķǽ�����ǿ�ڹ�Ԫ�أ���˹�����ȶ������ڼ��飻��3��������������ԭ���ͻ�ѧƽ�ⳣ����A����Ͷ�ϱ���ͬʱ���¶�Խ�ߣ����ȹ����ת����Խ������������ԭ��������ӦΪ���ȷ�Ӧ����A����B�����Ͷ�ϱ�Ϊn(H2)/n(SiHCl3)������Ͷ�ϱȵ����࣬��H2�����ӣ�ƽ��������Ӧ�����ƶ��������ȹ����ת����������ͼ��B��ȷ��C����Ϊ����ӦΪ���ȷ�Ӧ���һ�ѧƽ�ⳣ�� �¶ȵ�Ӱ�죬��������¶ȣ�ƽ��������Ӧ�����ƶ�������ѧƽ�ⳣ������C��ȷ��D��������������ԭ��������ѹǿ��ƽ�����淴Ӧ�����ƶ������ȹ����ת���ʽ��ͣ���D����
Mg2Si+2MgO���ܼ�����鶼���ڷ��Ӿ��壬C��ԭ�Ӱ뾶С��Si��Ҳ����C��H������Si��H�����̣���̼Ԫ�صķǽ�����ǿ�ڹ�Ԫ�أ���˹�����ȶ������ڼ��飻��3��������������ԭ���ͻ�ѧƽ�ⳣ����A����Ͷ�ϱ���ͬʱ���¶�Խ�ߣ����ȹ����ת����Խ������������ԭ��������ӦΪ���ȷ�Ӧ����A����B�����Ͷ�ϱ�Ϊn(H2)/n(SiHCl3)������Ͷ�ϱȵ����࣬��H2�����ӣ�ƽ��������Ӧ�����ƶ��������ȹ����ת����������ͼ��B��ȷ��C����Ϊ����ӦΪ���ȷ�Ӧ���һ�ѧƽ�ⳣ�� �¶ȵ�Ӱ�죬��������¶ȣ�ƽ��������Ӧ�����ƶ�������ѧƽ�ⳣ������C��ȷ��D��������������ԭ��������ѹǿ��ƽ�����淴Ӧ�����ƶ������ȹ����ת���ʽ��ͣ���D����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������������A��B��C��D��E����λ�ڲ�ͬ�����ڵ�Ԫ�أ����������γɶ���ԭ�Ӹ�����Ϊ1��1�Ļ�������еļס��ҡ�������4�ֻ������������������ӻ����A��B��ԭ������֮����Ԫ��D��һ�룮B���ǵ����ʵ���Ҫ��ɳɷ֣�Ҳ��ij�ֻ��ʵ���ɲ��֣�ֻ��CΪ����Ԫ�أ���ɫ��Ӧ�ʻ�ɫ����ش��������⣺
��1��Ԫ��E�����ڱ��е�λ����________________��
��2��B��D�γɵĻ����������Է���������170��190֮�䣬��D����������ԼΪ70%����û�����Ļ�ѧʽΪ_____��
��3��A��B�γɵĻ�������ΪB4A4����һ�������¿���1:1��ȫ��������������ӣ�����һ��Ϊ10e�������ӣ���������һ�������µĵ��뷽��ʽΪ_______________________��
��4��������C2D��Һ�ڿ����г��ڷ��û�������ɱ�C2D2���û�ѧ����ʽ��ʾ�ù���________��
��5��D��E��1:1�γɵĻ����ﶡ������ԭ�Ӿ�����8�����ȶ��ṹ���û�����ĵ���ʽΪ________����������ˮ���ҷ�Ӧ�������д̼�����ζ�Ļ������X��Y��ͬʱ���й��嵥�ʲ���������֪X��ʹƷ����Һ��ɫ�����壬Y�ڱ�״̬�µ��ܶ�Ϊ1.63g/L���û�����������H2���ܶ�Ϊ21���������̶�Ӧ�Ļ�ѧ����ʽΪ___________________________________��ij�о�С��ͬѧΪȷ�������X��Y���������Y�Ĵ��ڣ���Ʒ������£��Ѹ����X��Y������NH3��ϣ����ְ��̣���֤����Y���壬����Ϊ�˷���_______�����ȷ������ȷ������������__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������ֲ�ͬ�ṹ�������ʽΪC5H10O2������Ľṹ�У�������
A.3��
B.4��
C.5��
D.6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ���������������ơ�����������ۺ����ۻ���ת����ϵ��������ʾ������˵������ȷ���ǣ� ��

A. xΪNaOH��Һ��yΪ����
B. a��b�����ķ�ӦΪ��AlO2-+H++H2O=Al(OH)3��
C. ���ձ����̣�x��y������Ҳ�ܴﵽʵ��Ŀ��
D. b��c������ǿ��������ǿ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǣ�������
A.�ý����ƿ������Ҵ�������
B.�ø������������Һ�����ּ����3����ϩ
C.��ˮ�����ֱ����屽
D.�����Ƶ�������Һ�����ּ����������ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Թ���ʢ�е��ˮ��Һ������������CCl4�����������Ƭ�̺�
A. ������Һ����ɫ B. �ϲ���ɫ�²��Ϻ�ɫ
C. ������Һ���Ϻ�ɫ D. �ϲ��Ϻ�ɫ�²���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ��25���95��ʱ�������ƽ��������ͼ��ʾ��
��1����25��ʱˮ�ĵ���ƽ������ӦΪ���A����B��������˵������
��2��25��ʱ����pH=9��NaOH��Һ��pH=4��H2SO4��Һ��ϣ������û����Һ��pH=7����NaOH��Һ��H2SO4��Һ�������Ϊ ��
��3��95��ʱ����100���pH1=a��ijǿ����Һ��1���pH2=b��ijǿ����Һ��Ϻ���Һ�����ԣ�����ǰ����ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ�� ��
��4������B��Ӧ�¶��£�pH=2��HCl��Һ��pH=10��ijBOH��Һ�������Ϻ����Һ��pH=8���������ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���¶ȵ���570 0C ʱ����ԭ������ˮ������Ӧ�IJ�����FeO������570 0Cʱ������Fe3O4����ʦ����ͼ��ʾʵ��װ�ã�����˻�ԭ������ˮ������Ӧ����ʾʵ�顣
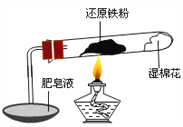
��ͬѧΪ̽��ʵ����Թ��ڵĹ��庬����Щ���ʣ�����������ʵ�飺
ʵ���� | ʵ����� | ʵ������ |
�� | ȡ������ɫ��ĩ�����Թ��У��������ᣬ�� | ��ɫ��ĩ���ܽ⣬��Һ��dz��ɫ�����������ݲ��� |
�� | ���Թ��еμӼ���KSCN��Һ���� | ��Һû�г���Ѫ��ɫ |
��������ʵ�飬����˵������ȷ���ǣ� ��
A. �Թ��ڵĹ���һ����������
B. �Թ��ڵĹ���һ��������Fe3O4
C. ����ȷ���Թ��ڵĹ���һ������FeO
D. ��ͨ�����Թ��ڹ��峹��ԭ��������������С�ķ�����ȷ���Ƿ���Fe3O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1L0.1mol/L Na2S2O3��Һ��һ������pH=2��������Һ��ϣ��ų�VL���壮NA��������٤��������ֵ������˵����ȷ���㣨 ��
A.pH=2��������Һ����H+��ĿΪ0.01NA
B.�÷�Ӧ�ͷ�SO2������ĿΪ ![]() NA
NA
C.��Ӧ��ÿĦ��Na2S2O3ת�Ƶĵ�����ĿΪ4NA
D.��98gH2SO4����ˮ��ȫ���룬����ѵĹ��ۼ���ĿΪ2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com