
【题目】已知丁基有四种不同结构,则分子式为C5H10O2的羧酸的结构有( )
A.3种
B.4种
C.5种
D.6种
科目:高中化学 来源: 题型:
【题目】有机物对香豆酸( ![]() )主要用于配置香辛樱桃、杏、蜂蜜等香料.
)主要用于配置香辛樱桃、杏、蜂蜜等香料.
(1)写出对香豆酸的分子式 .
(2)下列关于对香豆酸的说法不正确的是 .
a.能与NaOH溶液反应
b.能发生加成、取代、银镜反应
c.加金属钠,有氢气生成
d.加FeCl3溶液,溶液显紫色
(3)对香豆酸的某种同分异构体丁,可用于除草剂苯嗪草酮的中间体,其可通过下图转化关系制得. 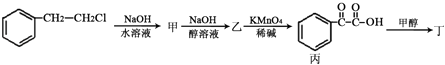
①乙→丙的反应类型;
②乙分子所含官能团是(填名称);
③丙→丁的反应化学方程式:;
(4)有机物戊与丁互为同分异构体,且满足以下特点:
①是苯的对位取代物,
②能与NaHCO3反应放出气体,
③能发生银镜反应.
请写出化合物戊的结构简式(任写一个即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O―→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。已知FeCO3易被氧化:4FeCO3+6H2O+O2===4Fe(OH)3+4CO2。某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:
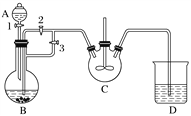
回答下列问题:
(1)NH4HCO3盛放在装置__________(填字母)中,该装置中涉及的主要反应的离子方程式________________________________________________________________________。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是____________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75 ℃下搅拌反应。铁粉的作用是________________________________________________________________________,反应结束后,无需过滤,除去过量铁粉的方法是_________________________________.
(4)经查阅文献后,该兴趣小组用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL,进行必要处理,用0.100 0 mol·L-1 Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70 mL。滴定反应如下:Ce4++Fe2+===Ce3++Fe3+,则产品中乳酸亚铁的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛{部分夹持仪器已略去)。

资料表明:室温下,四氯化钛为无色液体,熔点:-25℃,沸点:136.4℃。在空气中与水蒸气发生反应,形成发烟现象,生成二氧化钛固体。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)A处分液漏斗上方的胶皮管的作用是_______;
(2)实验中B装置中选用的试剂为______,该装置的作用是_________;
(3)D中物质制备的化学方程式为_________;
(4)E处球形冷凝管的作用是__________,该装置冷却水应从______(填“c”或“d")口通入;
(5)仪器F中盛装的物质是__________;
(6)该实验设计略有缺陷,请指出其不足之处: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质,G、J的焰色均为黄色。反应①为炼铁高炉中的重要反应;反应②可用于焊接铁轨。
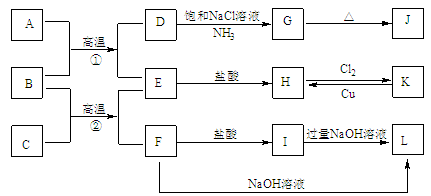
请回答下列问题:
(1)B的化学式为 ,J的化学式为 。
(2)工业上将氯气通入石灰乳中制取漂白粉,该反应的化学反应方程式为 。
(3)D→G是侯氏制碱法的主要反应,该反应的化学方程式为 。
(4)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 。
(5)F→L是铝土矿提纯中的重要反应,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 用盐酸酸化后,滴入AgNO3溶液产生白色沉淀,说明氯水中有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅晶体是信息技术的重要材料。
(1)工业上用石英和焦炭可以制得粗硅。已知反应过程的能量变化如下图


写出用石英和焦炭制取粗硅的热化学方程式______________________________。
(2)某同学设计下列流程制备高纯硅:

①Y的化学式为____________________。
②写出反应I的离子方程式________________________________________。
③写出反应IV的化学方程式________________________________________。
④甲烷分解的温度远远高于硅烷(SiH4),用原子结构解释其原因______________________________。
(3)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。

A.该反应是放热反应
B.横坐标表示的投料比可以是![]()
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com