
����Ŀ����֪���¶ȵ���570 0C ʱ����ԭ������ˮ������Ӧ�IJ�����FeO������570 0Cʱ������Fe3O4����ʦ����ͼ��ʾʵ��װ�ã�����˻�ԭ������ˮ������Ӧ����ʾʵ�顣
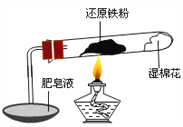
��ͬѧΪ̽��ʵ����Թ��ڵĹ��庬����Щ���ʣ�����������ʵ�飺
ʵ���� | ʵ����� | ʵ������ |
�� | ȡ������ɫ��ĩ�����Թ��У��������ᣬ�� | ��ɫ��ĩ���ܽ⣬��Һ��dz��ɫ�����������ݲ��� |
�� | ���Թ��еμӼ���KSCN��Һ���� | ��Һû�г���Ѫ��ɫ |
��������ʵ�飬����˵������ȷ���ǣ� ��
A. �Թ��ڵĹ���һ����������
B. �Թ��ڵĹ���һ��������Fe3O4
C. ����ȷ���Թ��ڵĹ���һ������FeO
D. ��ͨ�����Թ��ڹ��峹��ԭ��������������С�ķ�����ȷ���Ƿ���Fe3O4
���𰸡�B
����������ɫ��ĩ������������������ݲ���������һ���������ۣ�A��ȷ����ɫ��ĩ�������ۺ�Fe3O4��������������ܹ��������ӻ�ԭΪ�������ӣ����Բ���ȷ����ɫ��ĩ�Ƿ���Fe3O4��B�����������ᷴӦ������ð��˵��������������ȷ����ĩ���Ƿ���Fe3O4��FeO���������ᷴӦ������FeCl2�����������д���Fe3O4�������������ɵ�������������Ӧ�������������ӣ����Բ���ȷ���Թ��ڵĹ���һ������FeO��C��ȷ��FeO�к�������������Fe3O4�к�������������ͨ�����Թ��ڹ��峹��ԭ��������������С�ķ�����ȷ���Ƿ���Fe3O4�ǿ��е���D��ȷ����ȷѡ��B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��������������Ѽ��仯�������Ҫ�м��塣ijУ��ѧ����С����������ͼװ���Ʊ����Ȼ���{���ּг���������ȥ)��

���ϱ���:�����£����Ȼ���Ϊ��ɫҺ�壬�۵㣺-25�棬�е�:136.4�档�ڿ�������ˮ����������Ӧ���γɷ����������ɶ������ѹ��塣��650��850����,������ͨ���������Ѻ�̿�۵Ļ����ɵõ����Ȼ��Ѻ�һ���ж����塣�ش���������:
(1)A����Һ©���Ϸ��Ľ�Ƥ�ܵ�������_______��
(2)ʵ����Bװ����ѡ�õ��Լ�Ϊ______����װ�õ�������_________��
(3)D�������Ʊ��Ļ�ѧ����ʽΪ_________��
(4)E�����������ܵ�������__________����װ����ȴˮӦ��______(�c����d")��ͨ�룻
(5)����F��ʢװ��������__________��
(6)��ʵ���������ȱ�ݣ���ָ���䲻��֮��: _________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ��辧������Ϣ��������Ҫ���ϡ�
��1����ҵ����ʯӢ�ͽ�̿�����Ƶôֹ衣��֪��Ӧ���̵������仯����ͼ


д����ʯӢ�ͽ�̿��ȡ�ֹ���Ȼ�ѧ����ʽ______________________________��
��2��ijͬѧ������������Ʊ��ߴ��裺

��Y�Ļ�ѧʽΪ____________________��
��д����ӦI�����ӷ���ʽ________________________________________��
��д����ӦIV�Ļ�ѧ����ʽ________________________________________��
�ܼ���ֽ���¶�ԶԶ���ڹ��飨SiH4������ԭ�ӽṹ������ԭ��______________________________��
��3�����ֹ�ת�������ȹ��飨SiHCl3������һ����ӦҲ�����Ƶôֹ衣�䷴Ӧ��SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����
Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����

A���÷�Ӧ�Ƿ��ȷ�Ӧ
B���������ʾ��Ͷ�ϱȿ�����![]()
C���÷�Ӧ��ƽ�ⳣ�����¶����߶�����
D��ʵ��������Ϊ���SiHCl3�������ʣ������ʵ�����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��R2O82��������һ�������¿���Mn2+��������������Ӧ��R2O82�����ӱ�ΪRO42�����ӣ���֪��Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ5�U2��Mn2+���ӱ�������Ļ��ϼ�Ϊ
A. 4 B. 5 C. 6 D. 7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������������Լ��ͷ�������ȷ����
A. CO2(HCl)��������������Һ��ϴ��
B. KNO3(NaCl)�����ᾧ
C. ˮ(NaCl)��������
D. Cu(Fe)���������������ᣬ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������A��B��C��D��E,������һ���Ǽ�,��������,����ˮ�������Բ����±��е�����:
������ | Na+��H+��Ba2+ |
������ | OH-�� CO32-��SO42- |
Ϊ��������,�ֱ��������ʵ��,��������:
��A��Һ��B��Һ��Ӧ������ɫ����X,����X������C��Һ��Ӧ���ɳ���E,����E����B��Һ��Ӧ;
��B��Һ��C��Һ��Ӧ���ɰ�ɫ����D,����D������ϡ���ᡣ
���������ʵ����,���:
(1)д�����ʵĻ�ѧʽ:A______ X______��
(2) B����ˮ��ĵ��뷽��ʽΪ______________________��
����B�������ӵ�ʵ�����������_____________________��
(3)д�� A��Һ��B��Һ��Ӧ�����ӷ���ʽ:
________________________________________________________________________��
(4)D��E�Ļ����a g,������������,��Ӧ������ɱ�״���µ�����b L,��D�ڻ�����е���������Ϊ________�����г���ʽ���ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ10 mL�����ʵ���Ũ����ͬ������NaOH ��Һ�зֱ�ͨ��һ������CO2���õ���Һ���ҡ���ס�������Һ�зֱ�μ�0.1mol/L����������ʱ��Ӧ����CO2���(��״��)��������������Ĺ�ϵ��ͼ��ʾ�������������в���ȷ����

A. ԭNaOH��Һ�����ʵ���Ũ��Ϊ0.5 mol/L
B. ��0����)<10 mLʱ������Һ�з�����Ӧ�����ӷ���ʽΪH++CO32-=HCO3-
C. ����Һ�к��е�������Na2CO3��NaOH
D. ������Һ�еμӹ�����������CO2��������ֵΪ224 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��ԭ������������������ֶ�����Ԫ�أ�A��B��C��D��F�������е����ֻ�����Ԫ����ɵĻ����E����ZԪ���γɵĵ��ʣ�0.1molL-1 D��Һ��pHΪ13��25����������������ͼת����ϵ��������˵����ȷ����

A. ��X��Y��Z��W����Ԫ����ɵ�����ҺpHС��7
B. ������F�к��й��ۼ������Ӽ�
C. 0.1molB������C��ȫ��Ӧ��ת�Ƶ�����Ϊ0.2NA
D. ZԪ�ص��������Ϊ��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷�(FeSO4��7H2O)������ȱ����ƶѪҩƷ����Ҫ�ɷ֡���������������м(����������������������)Ϊԭ�����������̷���һ�ַ�����
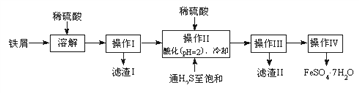
��ѯ���ϣ����й����ʵ��������±���
25��ʱ | ����H2S��Һ | SnS������ȫ | FeS��ʼ���� | FeS������ȫ |
pHֵ | 3.9 | 1.6 | 3.0 | 5.5 |
��1�������Ƶõ��̷��������Ƿ���Fe3+�����ѡ�õ��Լ�Ϊ____________________��
A.KSCN��ҺB.NaOH��ҺC.KMnO4��Һ
��2������II�У�ͨ�����������͵�Ŀ���ǣ�д���㣩___________��____________��
��3������IV��˳������Ϊ________����ȴ�ᾧ�����ˡ�
��4���ⶨ�̷���Ʒ��Fe2+�����ķ����ǣ�
a.��ȡ3.72g�̷���Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�
b.��ȡ25.00mL������Һ����ƿ�У�
c.�������ữ��0.01000mol/L KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL��
�ٵζ�ʱʢ��KMnO4��Һ������Ϊ_________�����������ƣ���
�ڼ���������Ʒ��FeSO47H2O����������Ϊ__________��
�������ⶨ�У����ζ��ܹ��Ϊ50mL������a�г�ȡ��Ʒ���������ܳ���______g��(����4λС��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com