
【题目】现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以与C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出物质的化学式:A______ X______。
(2) B溶于水后的电离方程式为______________________。
鉴别B中阴离子的实验操作方法是_____________________。
(3)写出 A溶液与B溶液反应的离子方程式:
________________________________________________________________________。
(4)D与E的混合物a g,加入足量盐酸,反应完毕生成标准状况下的气体b L,则D在混合物中的质量分数为________。(列出算式即可)
【答案】 A为Na2CO3 X、CO 2 NaHSO4=Na++H++SO42- 取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-; CO32-+2H+=CO2↑+H2O w(BaSO4)=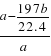 ×100%=1-
×100%=1-![]() ,故答案为:1-
,故答案为:1-![]() .
.
【解析】根据题意可知:生成的气体只有二氧化碳,反应2H++ CO32-= CO 2↑+ H2O,CO 2能够与C溶液反应生成沉淀E,则C为氢氧化钡,沉淀E为碳酸钡;沉淀E可与B溶液反应,B为硫酸氢钠;A溶液与B溶液反应生成无色气体X,X为二氧化碳,A为碳酸钠,B溶液与C溶液反应生成白色沉淀D,D为硫酸钡。
(1)由以上分析可知,A为Na2CO3,X为CO 2;正确答案:Na2CO3 ; CO 2。
(2) B为硫酸氢钠,溶于水后的电离方程式为NaHSO4=Na++H++SO42-,硫酸根离子检验方法:取少量B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-;正确答案:取少量B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-。
(3) A为碳酸钠,B为硫酸氢钠,碳酸钠溶液与硫酸氢钠反应生成二氧化碳、硫酸钠和水,反应的离子方程式CO32-+2H+=CO2↑+H2O;正确答案:CO32-+2H+=CO2↑+H2O。
(4) D为硫酸钡, E为碳酸钡,二者的混合物加入足量盐酸,硫酸钡不溶于盐酸,碳酸钡与盐酸反应,生成二氧化碳的体积b L,气体的量为b/22.4mol,则碳酸钡的量为b/22.4mol,质量为197 b/22.4 g,硫酸钡的质量为a-197 b/22.4 g,则硫酸钡的质量分数为w(BaSO4)=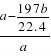 ×100%=1-
×100%=1-![]() ,正确答案:1-
,正确答案:1-![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某试管中盛有碘的水溶液,加入少量的CCl4,充分振荡,静置片刻后
A. 整个溶液变蓝色 B. 上层无色下层紫红色
C. 整个溶液显紫红色 D. 上层紫红色下层无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质特征是()
A.胶体在一定条件下能稳定存在
B.光束通过胶体时有丁达尔效应
C.胶体粒子直径在1-100 mm之间
D.胶体的分散质能通过滤纸空隙,而悬浊液的分散系不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在温度低于570 0C 时,还原铁粉与水蒸气反应的产物是FeO,高于570 0C时,生成Fe3O4。老师用上图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。
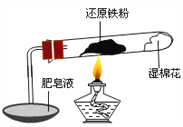
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,下列说法不正确的是( )
A. 试管内的固体一定含有铁粉
B. 试管内的固体一定不含有Fe3O4
C. 不能确定试管内的固体一定含有FeO
D. 可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某饱和NaCl溶液的体积为VmL,密度为ρg/cm3,质量分数为w%,物质的量浓度为cmol/L,溶液中含NaCl的质量为mg。则下列表达式正确的是
A. n(NaCl)=ρV/58.5 B. c(NaCl)=10ρw/58.5 C. w=m/ρV D. V=22.4m/58.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在标准状况下,11.2 L NO 与11.2 LO2混合后所含原子数为NA
B. 110 g Na2S2中含有的离子数为3NA
C. 0.1mol·L-1Na2CO3溶液1L所含阴离子数目小于0.1NA
D. 1mol Cl2溶于足量的水中,反应时断裂的Cl-Cl 键数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com