
����Ŀ��ԭ���������������A��B��C��D��E����λ�ڲ�ͬ�����ڵ�Ԫ�أ����������γɶ���ԭ�Ӹ�����Ϊ1��1�Ļ�������еļס��ҡ�������4�ֻ������������������ӻ����A��B��ԭ������֮����Ԫ��D��һ�룮B���ǵ����ʵ���Ҫ��ɳɷ֣�Ҳ��ij�ֻ��ʵ���ɲ��֣�ֻ��CΪ����Ԫ�أ���ɫ��Ӧ�ʻ�ɫ����ش��������⣺
��1��Ԫ��E�����ڱ��е�λ����________________��
��2��B��D�γɵĻ����������Է���������170��190֮�䣬��D����������ԼΪ70%����û�����Ļ�ѧʽΪ_____��
��3��A��B�γɵĻ�������ΪB4A4����һ�������¿���1:1��ȫ��������������ӣ�����һ��Ϊ10e�������ӣ���������һ�������µĵ��뷽��ʽΪ_______________________��
��4��������C2D��Һ�ڿ����г��ڷ��û�������ɱ�C2D2���û�ѧ����ʽ��ʾ�ù���________��
��5��D��E��1:1�γɵĻ����ﶡ������ԭ�Ӿ�����8�����ȶ��ṹ���û�����ĵ���ʽΪ________����������ˮ���ҷ�Ӧ�������д̼�����ζ�Ļ������X��Y��ͬʱ���й��嵥�ʲ���������֪X��ʹƷ����Һ��ɫ�����壬Y�ڱ�״̬�µ��ܶ�Ϊ1.63g/L���û�����������H2���ܶ�Ϊ21���������̶�Ӧ�Ļ�ѧ����ʽΪ___________________________________��ij�о�С��ͬѧΪȷ�������X��Y���������Y�Ĵ��ڣ���Ʒ������£��Ѹ����X��Y������NH3��ϣ����ְ��̣���֤����Y���壬����Ϊ�˷���_______�����ȷ������ȷ������������__________________________________________________��
���𰸡� �������ڢ�A�� N4S4 N4H4=NH4++N3�� 4Na2S+O2+2H2O=4NaOH+2Na2S2 ![]() 2S2Cl2+2H2O=SO2��+4HCl+3S�� ����ȷ ����Ķ��������백����Ӧ����������Ȼ����백����Ӧ���ɰ���
2S2Cl2+2H2O=SO2��+4HCl+3S�� ����ȷ ����Ķ��������백����Ӧ����������Ȼ����백����Ӧ���ɰ���
��������B���ǵ����ʵ���Ҫ��ɳɷ֣�Ҳ��ij�ֻ��ʵ���ɳɷ֣���BΪNԪ�أ�CΪ����Ԫ�أ���ɫ��Ӧ�ʻ�ɫ����CΪNaԪ�أ�A��B��ԭ������֮����Ԫ��D��һ�룬��D��ԭ������С��18����Aֻ��ΪHԪ�أ�D��ԭ������Ϊ��2����1+7��=16����DΪSԪ�أ�E�ܹ��γɻ�����Ķ�����Ԫ�أ���ԭ����������S������EΪClԪ�أ�
��1��EΪClԪ�أ�ԭ������Ϊ17��λ�����ڱ��е������ڵڢ���A�壻
��2��BΪNԪ�أ�DΪSԪ�أ��γɵĻ������У�S����������ԼΪ70%����N����������Ϊ30%����S��Nԭ�Ӹ�����Ϊ�� ![]() ��
�� ![]() =1��1������Է���������170��190֮�䣬�軯ѧʽΪ��SN��x����170<46x<190����xֻ��Ϊ4�����Զ����γɵĻ�����ķ���ʽΪ��S4N4����3��B4A4ΪN4H4��N4H4���������������ӣ�����һ��Ϊ10���ӵ�NH4+������NԪ����HԪ���غ��֪����һ������ӦΪN3-���õ��뷽��ʽΪ��N4H4=NH4++N3-����4��C2DΪNa2S��Na2S��Һ�ڿ����г��ڷ��ã���������Ӧ������Na2S2����Na2S��Һ�ڿ����б��ʹ��̵Ļ�ѧ����ʽΪ��4Na2S+O2+2H2O�T4NaOH+2Na2S2����5��D��E��Ԫ�طֱ�ΪS��Cl����ԭ�Ӹ�����1��1��ɻ����ﶡ�Ҹ�ԭ�Ӿ�����8���ӵ��ȶ��ṹ���仯ѧʽΪS2Cl2�������ʽΪ
=1��1������Է���������170��190֮�䣬�軯ѧʽΪ��SN��x����170<46x<190����xֻ��Ϊ4�����Զ����γɵĻ�����ķ���ʽΪ��S4N4����3��B4A4ΪN4H4��N4H4���������������ӣ�����һ��Ϊ10���ӵ�NH4+������NԪ����HԪ���غ��֪����һ������ӦΪN3-���õ��뷽��ʽΪ��N4H4=NH4++N3-����4��C2DΪNa2S��Na2S��Һ�ڿ����г��ڷ��ã���������Ӧ������Na2S2����Na2S��Һ�ڿ����б��ʹ��̵Ļ�ѧ����ʽΪ��4Na2S+O2+2H2O�T4NaOH+2Na2S2����5��D��E��Ԫ�طֱ�ΪS��Cl����ԭ�Ӹ�����1��1��ɻ����ﶡ�Ҹ�ԭ�Ӿ�����8���ӵ��ȶ��ṹ���仯ѧʽΪS2Cl2�������ʽΪ![]() ��S2Cl2��ˮ���ҷ�Ӧ�������д̼�����ζ�Ļ������X��Y��ͬʱ���й��嵥�ʲ�����X��һ����ʹƷ����Һ��ɫ�����壬��XΪ��������Y�ڱ�״̬�µ��ܶ�Ϊ1.63g/L��Y��Ħ������Ϊ��1.63g/L��22.4L/mol=36.5����YΪHCl�����ݻ��ϼ۱仯��֪������ΪS���û�����������H2���ܶ�Ϊ21����������ƽ����Է�������Ϊ��2��21=42�����������ж�����������ʵ���Ϊx��HClΪ�����ʵ���Ϊy����
��S2Cl2��ˮ���ҷ�Ӧ�������д̼�����ζ�Ļ������X��Y��ͬʱ���й��嵥�ʲ�����X��һ����ʹƷ����Һ��ɫ�����壬��XΪ��������Y�ڱ�״̬�µ��ܶ�Ϊ1.63g/L��Y��Ħ������Ϊ��1.63g/L��22.4L/mol=36.5����YΪHCl�����ݻ��ϼ۱仯��֪������ΪS���û�����������H2���ܶ�Ϊ21����������ƽ����Է�������Ϊ��2��21=42�����������ж�����������ʵ���Ϊx��HClΪ�����ʵ���Ϊy���� ![]() =42�������ɵã�x��y=1��4�����������غ㶨�ɿ�֪��÷�Ӧ�Ļ�ѧ����ʽΪ��2S2Cl2+2H2O=SO2��+4HCl��+3S����Ϊȷ�������SO2��HCl���������HCl�Ĵ��ڣ�����SO2������NH3����Ӧ����HCl�����NH3��Ӧ���ɰ��̣����ԿɰѸ����SO2��HCl������NH3��ϣ����ְ��̣���֤����HCl���壬�ʸü��鷽����ȷ��
=42�������ɵã�x��y=1��4�����������غ㶨�ɿ�֪��÷�Ӧ�Ļ�ѧ����ʽΪ��2S2Cl2+2H2O=SO2��+4HCl��+3S����Ϊȷ�������SO2��HCl���������HCl�Ĵ��ڣ�����SO2������NH3����Ӧ����HCl�����NH3��Ӧ���ɰ��̣����ԿɰѸ����SO2��HCl������NH3��ϣ����ְ��̣���֤����HCl���壬�ʸü��鷽����ȷ��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ͬ��������Һ�У�NH4+Ũ�������ǣ�������
A.NH4Cl
B.NH4HSO4
C.CH3COONH4
D.��NH4��2Fe��SO4��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�����㶹�ᣨ ![]() ����Ҫ������������ӣ�ҡ��ӡ����۵����ϣ�
����Ҫ������������ӣ�ҡ��ӡ����۵����ϣ�
��1��д�����㶹��ķ���ʽ ��
��2�����й��ڶ��㶹���˵������ȷ���� ��
a������NaOH��Һ��Ӧ
b���ܷ����ӳɡ�ȡ����������Ӧ
c���ӽ����ƣ�����������
d����FeCl3��Һ����Һ����ɫ
��3�����㶹���ij��ͬ���칹�嶡�������ڳ��ݼ���າ�ͪ���м��壬���ͨ����ͼת����ϵ�Ƶã� 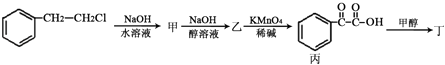
���ҡ����ķ�Ӧ������
���ҷ����������������������ƣ���
�۱������ķ�Ӧ��ѧ����ʽ����
��4���л������붡��Ϊͬ���칹�壬�����������ص㣺
���DZ��Ķ�λȡ���
������NaHCO3��Ӧ�ų����壬
���ܷ���������Ӧ��
��д����������Ľṹ��ʽ����дһ�����ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuS����HNO3��Һ��Ӧ,����SԪ�ر�����Ϊ+6�ۣ��һ�ԭ����NO��NO2��ͬ��ͬѹ�������Ϊ1:1,��μӷ�Ӧ��CuS�뱻��ԭ��HNO3���ʵ�����Ϊ
A. 1:4 B. 1:11 C. 1:6 D. 1:7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯һ��Ϊ��ѧ�仯����
A. �������ƹ��峱�� B. ̼���ƾ���绯 C. ������ D. �Ʊ�����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2A�ĵ��뷽��ʽΪ��H2A=H++HA����HA��H++A2�� �� ���ж�H2A������ʣ��ǿ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������([CH3CH(OH)COO]2Fe��3H2O��Mr��288)��һ�ֳ��õIJ���������ͨ��������̼��������Ӧ�Ƶã�CH3CH(OH)COOH��FeCO3��2H2O�D��[CH3CH(OH)COO]2Fe��3H2O��CO2������֪FeCO3�ױ�������4FeCO3��6H2O��O2===4Fe(OH)3��4CO2��ij��ȤС����FeCl2(�����ۺ�ϡ�����Ƶ�)��NH4HCO3�Ʊ�FeCO3��װ��ʾ��ͼ���£�
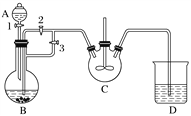
�ش��������⣺
��1��NH4HCO3ʢ����װ��__________(����ĸ)�У���װ�����漰����Ҫ��Ӧ�����ӷ���ʽ________________________________________________________________________��
��2�������ɵ�FeCl2��Һ��NH4HCO3��Һ���ʱ�IJ�����____________________��
��3�����Ƶõ�FeCO3���뵽����������Һ�У��ټ����������ۣ�75 ���½��跴Ӧ�����۵�������________________________________________________________________________����Ӧ������������ˣ���ȥ�������۵ķ�����_________________________________.
��4��������������ȤС������(Ce)�����ⶨ��Ʒ��Fe2���ĺ�����ȡ2.880 g��Ʒ���100 mL��Һ��ÿ��ȡ20.00 mL�����б�Ҫ��������0.100 0 mol��L��1 Ce(SO4)2����Һ�ζ����յ㣬ƽ������Ce(SO4)2 19.70 mL���ζ���Ӧ���£�Ce4����Fe2��===Ce3����Fe3�������Ʒ��������������������Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��������������Ѽ��仯�������Ҫ�м��塣ijУ��ѧ����С����������ͼװ���Ʊ����Ȼ���{���ּг���������ȥ)��

���ϱ���:�����£����Ȼ���Ϊ��ɫҺ�壬�۵㣺-25�棬�е�:136.4�档�ڿ�������ˮ����������Ӧ���γɷ����������ɶ������ѹ��塣��650��850����,������ͨ���������Ѻ�̿�۵Ļ����ɵõ����Ȼ��Ѻ�һ���ж����塣�ش���������:
(1)A����Һ©���Ϸ��Ľ�Ƥ�ܵ�������_______��
(2)ʵ����Bװ����ѡ�õ��Լ�Ϊ______����װ�õ�������_________��
(3)D�������Ʊ��Ļ�ѧ����ʽΪ_________��
(4)E�����������ܵ�������__________����װ����ȴˮӦ��______(�c����d")��ͨ�룻
(5)����F��ʢװ��������__________��
(6)��ʵ���������ȱ�ݣ���ָ���䲻��֮��: _________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ��辧������Ϣ��������Ҫ���ϡ�
��1����ҵ����ʯӢ�ͽ�̿�����Ƶôֹ衣��֪��Ӧ���̵������仯����ͼ


д����ʯӢ�ͽ�̿��ȡ�ֹ���Ȼ�ѧ����ʽ______________________________��
��2��ijͬѧ������������Ʊ��ߴ��裺

��Y�Ļ�ѧʽΪ____________________��
��д����ӦI�����ӷ���ʽ________________________________________��
��д����ӦIV�Ļ�ѧ����ʽ________________________________________��
�ܼ���ֽ���¶�ԶԶ���ڹ��飨SiH4������ԭ�ӽṹ������ԭ��______________________________��
��3�����ֹ�ת�������ȹ��飨SiHCl3������һ����ӦҲ�����Ƶôֹ衣�䷴Ӧ��SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����
Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȵı仯��ϵ��ͼ��ʾ������˵����ȷ����__________������ĸ����

A���÷�Ӧ�Ƿ��ȷ�Ӧ
B���������ʾ��Ͷ�ϱȿ�����![]()
C���÷�Ӧ��ƽ�ⳣ�����¶����߶�����
D��ʵ��������Ϊ���SiHCl3�������ʣ������ʵ�����ѹǿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com