
����Ŀ��ijͬѧΪ��̽���������ܽ�ƽ��ԭ�����ⶨij�¶���PbI2���ܶȻ����������������ʵ�飺
��ȡ100mL����ˮ�����������PbI2���壨��ɫ�������衢���ã����˵��ྻ���ձ��У��õ���Һa
��ȡ������Һa���Թ��У������м��뼸��0.1mol/L��KI��Һ���۲�����
����ȷ��ȡ10.00mL��Һ�������ӽ�����֬��RH��������Ӧ��2RH+Pb2+=R2Pb+2H+ �� ������ɺ�����Һ���к͵ζ������n��H+��=3.000��10��5mol�������̣�����˵��������ǣ� ��
A.����I�н����Ŀ����ʹ�⻯Ǧ����ܽ�
B.����II�й۲쵽�������Dz�����ɫ����
C.��ʵ���¶��£�PbI2���ܶȻ�����Ksp=1.350��10��8
D.������I ʢװ��Һ���ձ�����������ˮ��Ksp�IJⶨ�������Ӱ��
���𰸡�D
���������⣺A�������ܽ�ʱҪ�ò�������������ܽ⣬���Խ����Ŀ����ʹ�⻯Ǧ����ܽ⣬��A��ȷ��
B���⻯Ǧ������Һ�д��ڳ����ܽ�ƽ�⣬����Һ�еμӼ���0.1molL��1 KI��Һ���������Ũ���������ܽ�ƽ�����ƣ���Һ��c��Pb2+����С����Һ�л��������������Թ۲쵽������Ϊ��������ɫ�������ɫ���ǣ���B��ȷ��
C��ȷ��ȡ10.00mL��Һ�������ӽ�����֬��RH��������Ӧ��2RH+Pb2+=R2Pb+2H+ �� ������ɺ�������Һ���к͵ζ������n��H+��=3.000��10��5mol����n��Pb2+��=1.500��10��5mol������c��Pb2+��= ![]() =1.500��10��3mol/L������c��I����=2c��Pb2+��=3.000��10��3mol/L������Ksp��PbI2��=c��Pb2+����c2��I����=1.350��10��8 �� ��C��ȷ��
=1.500��10��3mol/L������c��I����=2c��Pb2+��=3.000��10��3mol/L������Ksp��PbI2��=c��Pb2+����c2��I����=1.350��10��8 �� ��C��ȷ��
D���������ʢװ��Һ���ձ���������ˮ������Һ��Ũ�ȼ�С����ȡ10.00mL��Һ������Һ�е����Ӻ�Ǧ���ӵ����ʵ���ƫС�����������KspƫС����D����
��ѡD��
A�������ܽ�ʱҪ�ò�������������ܽ⣻
B�����ݵ⻯Ǧ�����ܽ�ƽ���ƶ�������
C������Ksp��PbI2��=c��Pb2+����c2��I������������ӵ�Ũ�ȼ��㣻
D���������ʢװ��Һ���ձ���������ˮ������Һ��Ũ�ȼ�С�������KspƫС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ϊ������������ѧ�Ҹ���ᣬ���ʴ�����Ӧ�û�ѧ���ϻὫ112��Ԫ�صķ��Ŷ�Ϊ��Cn����������Ϊ��![]() �����ں������ú��ܷ��ϡ���̼���á���Ҫ�� 92U�Ǻ˷�Ӧ�ѵ���Ҫԭ�ϣ���ﮱ���Ϊ�����ܽ���������ȡ﮵�ԭ���Ǧ�﮻Կ�(��Ҫ�ɷ���LiAlSi2O6��������FeO��MgO��CaO������)�������й��������������漰Ԫ�ص�˵����ȷ����
�����ں������ú��ܷ��ϡ���̼���á���Ҫ�� 92U�Ǻ˷�Ӧ�ѵ���Ҫԭ�ϣ���ﮱ���Ϊ�����ܽ���������ȡ﮵�ԭ���Ǧ�﮻Կ�(��Ҫ�ɷ���LiAlSi2O6��������FeO��MgO��CaO������)�������й��������������漰Ԫ�ص�˵����ȷ����
A. ![]() Cn��ԭ�Ӻ�������������������֮��Ϊ55
Cn��ԭ�Ӻ�������������������֮��Ϊ55
B. 92U��92U��ͬλ�أ��˷�Ӧ���ڻ�ѧ�仯
C. 40Ca2����18O2������ͬ�ĵ�����
D. Si2O![]() �е�������Ϊ80
�е�������Ϊ80
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�����X��Y��Z��W������ɫ��Ӧ��Ϊ��ɫ�����ǰ����з�Ӧʽת���� ��X+Ca��OH��2��Y+CaCO3��
��W ![]() X+CO2��+H2O
X+CO2��+H2O
��Z+CO2��X+O2
��Z+H2O��Y+O2��
��X��Y��Z��W�����ǣ� ��
A.KCl��KOH��K2CO3��KHCO3
B.K2CO3��KOH��K2O2��KHCO3
C.K2SO3��KOH��K2O2��KHCO3
D.KHCO3��KOH��K2O2��K2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ա�����ȩΪԭ�ϣ����Ȼ���Ϊ�������Ʊ�1��1���������飬�䷴Ӧԭ��Ϊ��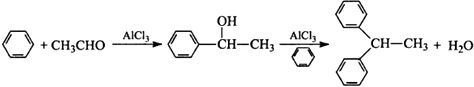
�Ʊ������������������AlCl3��������Ӧ����Ҫʵ��װ�úͲ������£�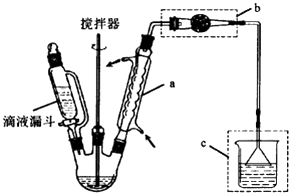
I���ϳɣ�
��250mL������ƿ�м���140mL�����ܶ�0.88g/mL����19gA1C13��5.5g��ȩ����20��ʱ��ַ�Ӧ��
�������ᴿ��
����Ӧ����ﵹ��װ��150mL����ˮ������������ձ��У���ֽ��裬�÷�Һ©��������л��㣬������ˮ��2%̼������Һ��ˮϴ�ӣ��ڷ�����Ĵֲ�Ʒ�м���������ˮ����þ���壬���˺��ȳ�ѹ�����ȥ�������ٸ��ü�ѹ�����ռ�170��172��/6.67kPa����֣���12.5g 1��l���������飮
��1������a�����ƣ�������������A1C13��������Ӧ�Ļ�ѧ����ʽΪ����װ��C�����ã� ��
��2������װ��b�������� ��
��3����ϴ�Ӳ����У��ڶ���ˮϴ����ҪĿ���� �� ʵ���м���������ˮ����þ��Ŀ���� ��
��4���ֲ�Ʒ��ѹ�����ᴿʱ������װ�����¶ȼ�λ����ȷ���� �� ���ܻᵼ���ռ����IJ�Ʒ�л��еͷе����ʵ�װ���� �� 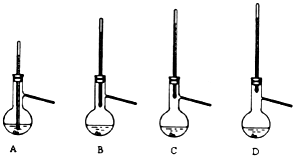
��5����ʵ�����õ���1��1�������������ԼΪ������ȷ�𰸵���ţ���
A.41%
B.48%
C.55%
D.65%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����������������ȷ���ǣ� ��
A.���³�ѹ�£�22.4 L NO2�к���NA������
B.1 mol�ǻ��е�����Ϊ10 NA
C.R2+��������ΪA��������ΪN����n g R�ü�̬���������к�������Ϊ ![]() ��A��N+8��NA
��A��N+8��NA
D.�ڷ�ӦKIO3+6HI�TKI+3I2+3H2O�У�ÿ����3 mol I2ת�Ƶĵ�����Ϊ6 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/molL��1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/molL��1 | 0.05 | 0.05 | 0.1 |
����˵��������ǣ� ��
A.��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50%
B.��Ӧ�ɱ�ʾΪX+3Y2Z����ƽ�ⳣ��Ϊ1600
C.����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������
D.�ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������ƿ����ʹ�÷�������������ȷ����
��������һ�����ʵ�����Ũ�ȵ���Һ��ר������
��ʹ��ǰҪ�ȼ������ƿ�Ƿ�©Һ ������ƿ������������
�ܲ���������ƿ�������ƺõ���Һ �ݿ�����400mL����ƿ����250mL��Һ
A. �ٺ͢� B. �ٺ͢� C. ���ˢ� D. ���ˢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ����ͼ��ʾװ�����ʵ�飬����̼��Ũ���ᷴӦ�IJ��

��1��д��Ũ�����ľ̿���ڼ��������·�����Ӧ�Ļ�ѧ����ʽ��___________��
��2������A��Ӧ������Լ���______��������____________��
��3������B��Ӧ������Լ���_____��������________��
��4����ʵ��С����C�м������������KMnO4��Һ��D�м�������ʯ��ˮ���ɸ���__________�����жϲ����д���CO2���塣C�з�����Ӧ�����ӷ���ʽΪ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦN2(g)��3H2(g) ![]() 2NH3(g)�������仯��ͼ��ʾ(��EΪ�����仯ֵ��a��b��c��Ϊ��ֵ)���������˵����ȷ����
2NH3(g)�������仯��ͼ��ʾ(��EΪ�����仯ֵ��a��b��c��Ϊ��ֵ)���������˵����ȷ����

A. �˷�ӦΪ���ȷ�Ӧ
B. 1mol N+3mol H�����������1mol NH3�����
C. 1mol NH3(l)ת��Ϊ1mol NH3(g)��Ҫ����c kJ����
D. ��ӦN2(g)��3H2(g) ![]() 2NH3(g)�������仯ֵΪa+b
2NH3(g)�������仯ֵΪa+b
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com