
����Ŀ��ʵ�����Ա�����ȩΪԭ�ϣ����Ȼ���Ϊ�������Ʊ�1��1���������飬�䷴Ӧԭ��Ϊ��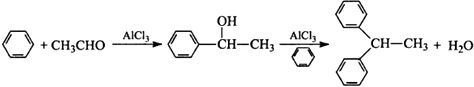
�Ʊ������������������AlCl3��������Ӧ����Ҫʵ��װ�úͲ������£�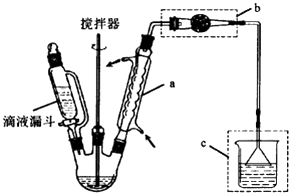
I���ϳɣ�
��250mL������ƿ�м���140mL�����ܶ�0.88g/mL����19gA1C13��5.5g��ȩ����20��ʱ��ַ�Ӧ��
�������ᴿ��
����Ӧ����ﵹ��װ��150mL����ˮ������������ձ��У���ֽ��裬�÷�Һ©��������л��㣬������ˮ��2%̼������Һ��ˮϴ�ӣ��ڷ�����Ĵֲ�Ʒ�м���������ˮ����þ���壬���˺��ȳ�ѹ�����ȥ�������ٸ��ü�ѹ�����ռ�170��172��/6.67kPa����֣���12.5g 1��l���������飮
��1������a�����ƣ�������������A1C13��������Ӧ�Ļ�ѧ����ʽΪ����װ��C�����ã� ��
��2������װ��b�������� ��
��3����ϴ�Ӳ����У��ڶ���ˮϴ����ҪĿ���� �� ʵ���м���������ˮ����þ��Ŀ���� ��
��4���ֲ�Ʒ��ѹ�����ᴿʱ������װ�����¶ȼ�λ����ȷ���� �� ���ܻᵼ���ռ����IJ�Ʒ�л��еͷе����ʵ�װ���� �� 
��5����ʵ�����õ���1��1�������������ԼΪ������ȷ�𰸵���ţ���
A.41%
B.48%
C.55%
D.65%
���𰸡�
��1�����������ܣ�AlCl3+3H2O?Al��OH��3+3HCl������HCl����
��2����ֹ�ձ��е�ˮ�������뷴Ӧ���������Ȼ�����Ӧ
��3��ϴ���Ȼ����������̼���Ƶȿ������������
��4��C��AB
��5��C
���������⣺��1���������ṹ��������֪����aΪ���������ܣ���Ӧ������ AlCl3�ᷢ��ˮ�⣬�ʻ����ɸ�����������������Ӧ����ʽΪ��AlCl3+3H2OAl��OH��3+3HCl��cװ������HCl���ĵ��õ�©���������ٽ�HCl��������գ���ֹ���������Դ��ǣ����������ܣ�AlCl3+3H2OAl��OH��3+3HCl������HCl���壻��2������ AlCl3�ᷢ��ˮ�⣬��ʵ������Ҫ��ֹˮ�� AlCl3��ˮ�Ӵ���װ��b������Ϊ����ֹ�ձ��е�ˮ�������뷴Ӧ���������Ȼ�����Ӧ�����Դ��ǣ���ֹ�ձ��е�ˮ�������뷴Ӧ���������Ȼ�����Ӧ����3���ڶ�����ˮϴ����Ϊ��ϴ���Ȼ����������̼���Ƶȿ����������ˮ����þ��Ϊ����������ˮ�����������ã����Դ��ǣ�ϴ���Ȼ����������̼���Ƶȿ�������������4������������¶ȼ�ˮ����λ��������ƿ��֧�ܿڴ�����ѡC�������¶ȼ�ˮ����ֱ�ӻ���֧�ܿ��·���ǰ�Ӵ����������ܻᵼ���ռ����IJ�Ʒ�л��еͷе����ʣ���AB�����Դ��ǣ�C��AB����5�������ʵ���Ϊ ![]() =1.58mol����ȩ���ʵ���Ϊ
=1.58mol����ȩ���ʵ���Ϊ ![]() =0.125mol���ɷ���ʽ��֪��n����ȩ��=n������������ȩ���㣬��n����ȩ��=n��1��l���������飩=0.125mol����������1��l���������������Ϊ��0.125mol��178g/mol=22.25g����ʵ������1��l����������Ϊ12.5g����1��l����������IJ���Ϊ��
=0.125mol���ɷ���ʽ��֪��n����ȩ��=n������������ȩ���㣬��n����ȩ��=n��1��l���������飩=0.125mol����������1��l���������������Ϊ��0.125mol��178g/mol=22.25g����ʵ������1��l����������Ϊ12.5g����1��l����������IJ���Ϊ�� ![]() ��100%=55%����ѡ��C��
��100%=55%����ѡ��C��


 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ���к���һ������þ���������ʣ��ӵ����е����ʧ��Ҫ���������ʡ�ˮ�ݡ������е������Լ����ա����ȶ�����ģ���֪��
�����ԣ�IO ![]() ��Fe3+��I2����ԭ�ԣ�S2O
��Fe3+��I2����ԭ�ԣ�S2O ![]() ��I��
��I��
3I2+6OH���T5I��+IO ![]() +3H2O KI+I2=KI3
+3H2O KI+I2=KI3
��1��ijѧϰС��Լӵ��ν���������ʵ�飺ȡһ����ij�ӵ��Σ����ܺ���KIO3��KI��Mg2+��Fe3+��������������ˮ�ܽ⣬����ϡ�����ữ����������Һ��Ϊ3�ݣ���һ����Һ�еμ�KSCN��Һ���Ժ�ɫ���ڶ�����Һ�м�����KI���壬��Һ�Ե���ɫ����CCl4��ȡ���²���Һ���Ϻ�ɫ����������Һ�м�������KIO3����μӵ����Լ�����Һ����ɫ��
�ټ�KSCN��Һ�Ժ�ɫ���ú�ɫ���������û�ѧʽ��ʾ����CCl4�����Ϻ�ɫ�����������õ���ʽ��ʾ����
�ڵڶ�����Һ�м�������KI�����Ӧ�����ӷ���ʽΪ�� ��
��2��KI��Ϊ�ӵ����ʳ���ڱ�������У����ڿ��������������ã�������������ʧ��д����ʪ������KI��������Ӧ�Ļ�ѧ����ʽ�� �� ��I2����KI��Һ���ڵ��������£����Ƶ�KI3H2O����������Ϊʳ�μӵ���Ƿ���ʣ�����ǡ�������˵�����ɣ� ��
��3��Ϊ����ӵ��Σ�����KI�����ȶ��ԣ��ɼ��ȶ������ٵ����ʧ�������������п�����Ϊ�ȶ������� ��
A.Na2S2O3
B.AlCl3
C.Na2CO3
D.NaNO2
��4���Ժ�Fe2+�϶��ʳ�Σ����費��Fe3+������ѡ��KI��Ϊ�ӵ���������ʵ�鷽��������üӵ����е�Fe2+�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������ȼ�ϵ�أ�������Ϊ�缫����KOH��Һ�У��ֱ�������ͨ�����飨C2H6��������������ijһ�缫��ӦʽΪC2H6+18OH����14e���T2CO ![]() +12H2O���йش˵�ص��ƶϲ���ȷ���ǣ� ��
+12H2O���йش˵�ص��ƶϲ���ȷ���ǣ� ��
A.ͨ�������ĵ缫Ϊ����
B.�μӷ�Ӧ��O2��C2H6�����ʵ���֮��Ϊ7��2
C.�ŵ�һ��ʱ���KOH�����ʵ���Ũ�Ƚ��½�
D.�ŵ�һ��ʱ���������������Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��16���ͳ����ҹ������������ϵ�һ����Ȼ��������Ȼ������Ҫ�ɷ���
A.COB.CH4C.NO2D.H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������뽺��������ص��ǣ� ��
A. ��������̫�������������B. ��ҵ�̴Ѿ������
C. ��ȡ��ҺD. �����뺣���γ���ɳ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ����
A. ��֪�����ȼ����Ϊ890.3 kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H����890.3 kJmol-1
B. ��֪ǿ���ǿ���ϡ��Һ��Ӧ���к���Ϊ57.3 kJmol-1����CH3COOH��OH����CH3COO����H2O ��H����57.3 kJmol-1
C. һ�������£���0.5mol N2��1.5mol H2�����ܱ������У���ַ�Ӧ����NH3(g)���ų�����19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)��3H2(g)![]() 2NH3(g) ��H����38.6 kJmol-1
2NH3(g) ��H����38.6 kJmol-1
D. ��֪1g N2H4(l)������H2O2(l)��Ӧ���ɵ�����ˮ�������ų�����20.05kJ�����Ȼ�ѧ����ʽ�ɱ�ʾΪ��N2H4(l)��2H2O2(l)��N2(g)��4H2O(g) ��H����641.6 kJmol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ��̽���������ܽ�ƽ��ԭ�����ⶨij�¶���PbI2���ܶȻ����������������ʵ�飺
��ȡ100mL����ˮ�����������PbI2���壨��ɫ�������衢���ã����˵��ྻ���ձ��У��õ���Һa
��ȡ������Һa���Թ��У������м��뼸��0.1mol/L��KI��Һ���۲�����
����ȷ��ȡ10.00mL��Һ�������ӽ�����֬��RH��������Ӧ��2RH+Pb2+=R2Pb+2H+ �� ������ɺ�����Һ���к͵ζ������n��H+��=3.000��10��5mol�������̣�����˵��������ǣ� ��
A.����I�н����Ŀ����ʹ�⻯Ǧ����ܽ�
B.����II�й۲쵽�������Dz�����ɫ����
C.��ʵ���¶��£�PbI2���ܶȻ�����Ksp=1.350��10��8
D.������I ʢװ��Һ���ձ�����������ˮ��Ksp�IJⶨ�������Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2CO3(aq)�����ᷴӦ�����е������仯ʾ��ͼ���£�����ѡ����ȷ����
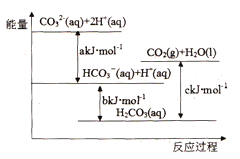
A. H2CO3(aq)=CO2(g)+H2O(l)Ϊ���ȷ�Ӧ
B. CO32-(aq)+ H+(aq)=HCO3-(aq) ��H=akJ/mol
C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) ��H=(c-b)kJ/mol
D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) ��H=(a+b-c)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д����������
A. Ag+��Na+��NO3-��Cl-B. K+��H+��SO42-��OH-
C. Na+��Cu2+��Cl-��SO42-D. K+��H+��Cl-��CO32-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com