
����Ŀ��ʳ���к���һ������þ���������ʣ��ӵ����е����ʧ��Ҫ���������ʡ�ˮ�ݡ������е������Լ����ա����ȶ�����ģ���֪��
�����ԣ�IO ![]() ��Fe3+��I2����ԭ�ԣ�S2O
��Fe3+��I2����ԭ�ԣ�S2O ![]() ��I��
��I��
3I2+6OH���T5I��+IO ![]() +3H2O KI+I2=KI3
+3H2O KI+I2=KI3
��1��ijѧϰС��Լӵ��ν���������ʵ�飺ȡһ����ij�ӵ��Σ����ܺ���KIO3��KI��Mg2+��Fe3+��������������ˮ�ܽ⣬����ϡ�����ữ����������Һ��Ϊ3�ݣ���һ����Һ�еμ�KSCN��Һ���Ժ�ɫ���ڶ�����Һ�м�����KI���壬��Һ�Ե���ɫ����CCl4��ȡ���²���Һ���Ϻ�ɫ����������Һ�м�������KIO3����μӵ����Լ�����Һ����ɫ��
�ټ�KSCN��Һ�Ժ�ɫ���ú�ɫ���������û�ѧʽ��ʾ����CCl4�����Ϻ�ɫ�����������õ���ʽ��ʾ����
�ڵڶ�����Һ�м�������KI�����Ӧ�����ӷ���ʽΪ�� ��
��2��KI��Ϊ�ӵ����ʳ���ڱ�������У����ڿ��������������ã�������������ʧ��д����ʪ������KI��������Ӧ�Ļ�ѧ����ʽ�� �� ��I2����KI��Һ���ڵ��������£����Ƶ�KI3H2O����������Ϊʳ�μӵ���Ƿ���ʣ�����ǡ�������˵�����ɣ� ��
��3��Ϊ����ӵ��Σ�����KI�����ȶ��ԣ��ɼ��ȶ������ٵ����ʧ�������������п�����Ϊ�ȶ������� ��
A.Na2S2O3
B.AlCl3
C.Na2CO3
D.NaNO2
��4���Ժ�Fe2+�϶��ʳ�Σ����費��Fe3+������ѡ��KI��Ϊ�ӵ���������ʵ�鷽��������üӵ����е�Fe2+�� ��
���𰸡�
��1��Fe��SCN��3��![]() ��IO3��+5I��+6H+�T3I2+3H2O��2Fe3++2I���T2Fe2++I2
��IO3��+5I��+6H+�T3I2+3H2O��2Fe3++2I���T2Fe2++I2
��2����4KI+O2+2H2O�T2I2+4KOH��KI3���ȣ���ʪ�������²���KI��I2 �� KI������������I2������
��3��C
��4��ȡ�����üӵ�����������ˮ�У��������ữ���μ��������������磺��ˮ����������ȣ����ٵμ�KSCN��Һ������Ѫ��ɫ����üӵ����д���Fe2+
���������⣺��1��ij�ӵ��ο��ܺ���KIO3��KI��Mg2+��Fe3+ �� ������ˮ�ܽ⣬����ϡ�����ữ����Һ��Ϊ3�ݣ��ӵ�һ����Һ�еμ�KSCN��Һ���Ժ�ɫ����֪�üӵ����к���Fe3+ �� ��Ӧ��Fe3++3SCN��=Fe��SCN��3 �� Fe��SCN��3��Ѫ��ɫ���ӵڶ�����Һ�м�����KI���壬��Һ�Ե���ɫ����CCl4��ȡ���²���Һ���Ϻ�ɫ����֪�е����ɣ�������Ϊ���ڡ������ԣ�IO3����Fe3+��I2����������KI��IO3����Fe3+���ܽ�I��������I2 �� �ɴ�Ҳ����֪���üӵ�������KIO3����������Һ�м�������KIO3����μӵ����Լ�����Һ����ɫ���ɴ˿�֪�üӵ����в���KI��
�ٸüӵ�����Һ�м�KSCN��Һ�Ժ�ɫ��������Fe��SCN��3 �� CCl4�����Ϻ�ɫ��������I2 �� ����ʽ ![]() �����Դ��ǣ�Fe��SCN��3��
�����Դ��ǣ�Fe��SCN��3�� ![]() �� �ڵڶ�����Һ�м�������KI�����Ӧ�����ӷ���ʽΪIO3��+5I��+6H+�T3I2+3H2O��2Fe3++2I���T2Fe2++I2 �� ���Դ��ǣ�IO3��+5I��+6H+�T3I2+3H2O��2Fe3++2I���T2Fe2++I2����2��KI��Ϊ�ӵ����ʳ���ڱ�������У�KI�ᱻ����������������KI�ڳ�ʪ�����������ķ�Ӧ��ѧ����ʽΪ��4KI+O2+2H2O�T2I2+4KOH��������Ŀ��֪��KI3H2O���ڵ��������£���I2����KI��Һ���Ƶã������������Ϣ����KI+I2
�� �ڵڶ�����Һ�м�������KI�����Ӧ�����ӷ���ʽΪIO3��+5I��+6H+�T3I2+3H2O��2Fe3++2I���T2Fe2++I2 �� ���Դ��ǣ�IO3��+5I��+6H+�T3I2+3H2O��2Fe3++2I���T2Fe2++I2����2��KI��Ϊ�ӵ����ʳ���ڱ�������У�KI�ᱻ����������������KI�ڳ�ʪ�����������ķ�Ӧ��ѧ����ʽΪ��4KI+O2+2H2O�T2I2+4KOH��������Ŀ��֪��KI3H2O���ڵ��������£���I2����KI��Һ���Ƶã������������Ϣ����KI+I2![]() KI3������֪KI3�ڳ����²��ȶ��ԣ����ȣ���ʪ���������ֽ�ΪKI��I2 �� KI���ױ������е�����������I2������������KI3H2O��Ϊʳ�μӵ���Dz����ʵģ����Դ��ǣ�4KI+O2+2H2O�T2I2+4KOH����KI3���ȣ���ʪ�������²���KI��I2 �� KI������������I2����������3����ӵ��Σ�����KI�����ȶ��ԣ���Ҫ�Ƿ�ֹI�� �����������������Ϣ����ԭ�ԣ�S2O32����I������������ԭ��Ӧ��ǿ�����ɣ�����ѡNa2S2O3���ȶ��������������Ϣ����3I2+6OH���TIO3��+5I��+3H2O������֪I2��OH���ᷢ����Ӧ����IO3����5I�� �� ��Na2CO3ˮ��ʼ��ԣ����Ҳ������Na2CO3���ȶ�������ֹ�ӵ��Σ�����KI���ڳ�ʪ�����±�����������AlCl3 �� ˮ�������ԣ��һ�ԭ��I����Cl�� �� ���������ȶ�����NaNO2����ǿ��ԭ������ʱ�ܱ��ֳ������ԣ���NaNO2��KI�ܷ���������ԭ��ӦΪ2NO2��+2I��+4H+=2NO��+I2+2H2O�����Բ������ȶ��������Դ��ǣ�AC����4��ʵ���Ͼ������ʵ�鷽��������Fe2+ �� ���ȿ�ȡ�����üӵ�����������ˮ�У�Ȼ���������ữ�μ��������������磺��ˮ����������ȣ���ʹ��Һ��Fe2+ת��ΪFe3+ �� �ٵμ�KSCN��Һ������Ѫ��ɫ����üӵ����д���Fe2+ �� ���Դ��ǣ�ȡ�����üӵ�����������ˮ�У��������ữ���μ��������������磺��ˮ����������ȣ����ٵμ�KSCN��Һ������Ѫ��ɫ����üӵ����д���Fe2+ ��
KI3������֪KI3�ڳ����²��ȶ��ԣ����ȣ���ʪ���������ֽ�ΪKI��I2 �� KI���ױ������е�����������I2������������KI3H2O��Ϊʳ�μӵ���Dz����ʵģ����Դ��ǣ�4KI+O2+2H2O�T2I2+4KOH����KI3���ȣ���ʪ�������²���KI��I2 �� KI������������I2����������3����ӵ��Σ�����KI�����ȶ��ԣ���Ҫ�Ƿ�ֹI�� �����������������Ϣ����ԭ�ԣ�S2O32����I������������ԭ��Ӧ��ǿ�����ɣ�����ѡNa2S2O3���ȶ��������������Ϣ����3I2+6OH���TIO3��+5I��+3H2O������֪I2��OH���ᷢ����Ӧ����IO3����5I�� �� ��Na2CO3ˮ��ʼ��ԣ����Ҳ������Na2CO3���ȶ�������ֹ�ӵ��Σ�����KI���ڳ�ʪ�����±�����������AlCl3 �� ˮ�������ԣ��һ�ԭ��I����Cl�� �� ���������ȶ�����NaNO2����ǿ��ԭ������ʱ�ܱ��ֳ������ԣ���NaNO2��KI�ܷ���������ԭ��ӦΪ2NO2��+2I��+4H+=2NO��+I2+2H2O�����Բ������ȶ��������Դ��ǣ�AC����4��ʵ���Ͼ������ʵ�鷽��������Fe2+ �� ���ȿ�ȡ�����üӵ�����������ˮ�У�Ȼ���������ữ�μ��������������磺��ˮ����������ȣ���ʹ��Һ��Fe2+ת��ΪFe3+ �� �ٵμ�KSCN��Һ������Ѫ��ɫ����üӵ����д���Fe2+ �� ���Դ��ǣ�ȡ�����üӵ�����������ˮ�У��������ữ���μ��������������磺��ˮ����������ȣ����ٵμ�KSCN��Һ������Ѫ��ɫ����üӵ����д���Fe2+ ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼA��K������ѧ��ѧʵ����ʹ�õĻ��ܹ��Ʊ������ʣ���֪A��K�����в�����ij���۽���Ԫ��X�Ļ������һЩ�Ǻ������ǽ���Ԫ��Y�����ʣ���C��E��G��K�����壬���ʼ������·�Ӧ��ϵ��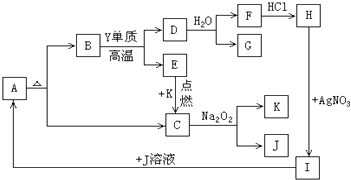
�����
��1��Ԫ��X�ķ��� �� Ԫ��Y������ ��
��2��д����ӦD��G+F�Ļ�ѧ����ʽ ��
��3��д����ӦC��K+J�Ļ�ѧ����ʽ ��
��4����I�⣬����������ĸ������J��Һ��Ӧ����A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е����ɵ��Ӹ����ڷ��ӻ�ԭ�����γɿ��������ӣ�����Ϊ������ά��������O2-����һ�ֿ��������ӣ���Ħ������Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ䲻�ܷ������ӷ�Ӧ���� �� ��
A. Na2SO4��Һ��BaCl2��Һ B. ��Ƭ����Hg(NO3)2��Һ
C. NaNO3��Һ��KCl��Һ D. Na2CO3��Һ��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɶ�����Ԫ����ɵ�����֮���ת����ϵ����ͼ��ʾ�����У�AΪ����Ԫ����ɵĻ������Ӧ��������C��D���ʵ���֮��Ϊ3��4��D�Dz�����ˮ�İ�ɫ���壬����Ӧ�ۢ���������Ӧ������Һ�н��У�F��G����̬�ǽ������ʣ�K��һ�ֳ����ķǼ����л��ܼ����ܶȱ�ˮ��ijЩ������ͷ�Ӧ��������ȥ��
��1����Ӧ�۵�����Ϊ��
��2��A�Ļ�ѧʽ����K�ĵ���ʽ��
��3��д���ٷ�Ӧ�Ļ�ѧ����ʽ����
��4�����F��Ԫ����Ԫ�����ڱ��е�λ������
��5��E�н��������ӵļ��鷽����
��6��д����Ӧ�ߵ����ӷ���ʽ����
��7�������ӷ���ʽ��ʾH��Һ�Լ��Ե�ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ơ�þ������п4�ֽ��������е�������ɵĺϽ�48 g�������������ᷴӦ����22.4 L��������״��������ô�˺Ͻ���һ�����еĽ����ǣ� ��
A.Na
B.Mg
C.Al
D.Zn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ϊ������������ѧ�Ҹ���ᣬ���ʴ�����Ӧ�û�ѧ���ϻὫ112��Ԫ�صķ��Ŷ�Ϊ��Cn����������Ϊ��![]() �����ں������ú��ܷ��ϡ���̼���á���Ҫ�� 92U�Ǻ˷�Ӧ�ѵ���Ҫԭ�ϣ���ﮱ���Ϊ�����ܽ���������ȡ﮵�ԭ���Ǧ�﮻Կ�(��Ҫ�ɷ���LiAlSi2O6��������FeO��MgO��CaO������)�������й��������������漰Ԫ�ص�˵����ȷ����
�����ں������ú��ܷ��ϡ���̼���á���Ҫ�� 92U�Ǻ˷�Ӧ�ѵ���Ҫԭ�ϣ���ﮱ���Ϊ�����ܽ���������ȡ﮵�ԭ���Ǧ�﮻Կ�(��Ҫ�ɷ���LiAlSi2O6��������FeO��MgO��CaO������)�������й��������������漰Ԫ�ص�˵����ȷ����
A. ![]() Cn��ԭ�Ӻ�������������������֮��Ϊ55
Cn��ԭ�Ӻ�������������������֮��Ϊ55
B. 92U��92U��ͬλ�أ��˷�Ӧ���ڻ�ѧ�仯
C. 40Ca2����18O2������ͬ�ĵ�����
D. Si2O![]() �е�������Ϊ80
�е�������Ϊ80
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��W��X��Y��Z��ԭ�����������������ϱ�����Ϣ�ش��������⣮
W | X | Y | Z | |
�ṹ������ | ����������Ӧ��ˮ����������̬�⻯�ﷴӦ�õ����ӻ����� | ��ɫ��Ӧ�ʻ�ɫ | ��ͬ��������Ԫ���γɵļ������У����Ӱ뾶��С | ��������������֮��Ϊ�� |
��1��Z��Ԫ�����ڱ���λ���壮
��2������Ԫ�ص�����������Ӧ��ˮ�����У���һ��������һ�������¾����������������ʷ�����ѧ��Ӧ����Ԫ��������Ԫ�ط��ţ���
��3�������п���Ϊ�Ƚ�X��Y������ǿ����������������ţ���a����Ȼ���еĺ���
b����Ӧ�Ȼ���ˮ��Һ��pH
c��������ˮ��Ӧ�����׳̶�
d���������ᷴӦʱʧȥ�ĵ�����
�ڴ�ԭ�ӽṹ�ĽǶȽ���X�Ľ�����ǿ��Y��ԭ�� ��
��4��W��һ���⻯��HW3�������л��ϳɣ���������������ƣ������Ũ�Ⱦ���ȵ�HW3��X������������Ӧ��ˮ�������Һ��ϣ���Ӧ�Ļ�ѧ����ʽ�� �� ��Ϻ���Һ������Ũ���ɴ�С��˳���� ��
��5��Y���ʺ�Mg��ɵĻ������һ�����ԭ�ϣ�ij��ȤС�����������ʾ��ʵ�鷽�����ⶨ�������Y������������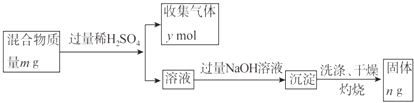
��ȷ���������Y������������������������ţ���
a��m��n b��m��y c��n��y��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ա�����ȩΪԭ�ϣ����Ȼ���Ϊ�������Ʊ�1��1���������飬�䷴Ӧԭ��Ϊ��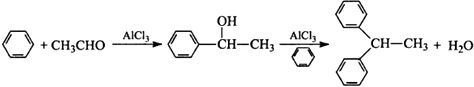
�Ʊ������������������AlCl3��������Ӧ����Ҫʵ��װ�úͲ������£�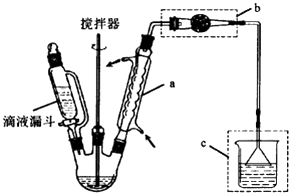
I���ϳɣ�
��250mL������ƿ�м���140mL�����ܶ�0.88g/mL����19gA1C13��5.5g��ȩ����20��ʱ��ַ�Ӧ��
�������ᴿ��
����Ӧ����ﵹ��װ��150mL����ˮ������������ձ��У���ֽ��裬�÷�Һ©��������л��㣬������ˮ��2%̼������Һ��ˮϴ�ӣ��ڷ�����Ĵֲ�Ʒ�м���������ˮ����þ���壬���˺��ȳ�ѹ�����ȥ�������ٸ��ü�ѹ�����ռ�170��172��/6.67kPa����֣���12.5g 1��l���������飮
��1������a�����ƣ�������������A1C13��������Ӧ�Ļ�ѧ����ʽΪ����װ��C�����ã� ��
��2������װ��b�������� ��
��3����ϴ�Ӳ����У��ڶ���ˮϴ����ҪĿ���� �� ʵ���м���������ˮ����þ��Ŀ���� ��
��4���ֲ�Ʒ��ѹ�����ᴿʱ������װ�����¶ȼ�λ����ȷ���� �� ���ܻᵼ���ռ����IJ�Ʒ�л��еͷе����ʵ�װ���� �� 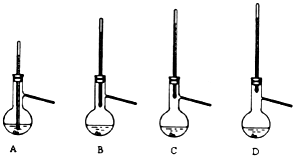
��5����ʵ�����õ���1��1�������������ԼΪ������ȷ�𰸵���ţ���
A.41%
B.48%
C.55%
D.65%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com