
【题目】四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
W | X | Y | Z | |
结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是(填序号).a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: .
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 , 混合后溶液中离子浓度由大到小的顺序是 .
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.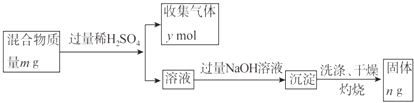
能确定混合物中Y的质量分数的数据有(填序号).
a.m、n b.m、y c.n、y.
【答案】
(1)ⅣA
(2)Na
(3)bc;电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al
(4)HN3+NaOH═NaN3+H2O;c(Na+)>c(N3﹣)>c(OH﹣)>c(H+)
(5)abc
【解析】解:四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,Z最高正价与最低负价之和为零,则Z为Si元素.(1)Z是Si元素,处于第ⅣA族,故答案为:ⅣA;(2)W形成的最高价氧化物的水化物是硝酸,X的最高价氧化物的水化物是氢氧化钠,Y的最高价氧化物的水化物是氢氧化铝,Z的最高价氧化物的水化物是硅酸,氢氧化钠和其他三种物质能反应,所以该元素是Na,故答案为:Na;(3)①比较金属性强弱的方法有:金属元素最高价氧化物的水化物碱性强弱、金属之间的置换反应、和酸或水反应生成氢气的难易程度、形成的氯化物溶液酸性强弱等,故选:bc;②电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al,故答案为:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al;(4)HN3的酸性与醋酸的相当,则HN3为弱酸,与NaOH发生中和反应,反应方程式为:HN3+NaOH═NaN3+H2O;等体积、等浓度,二者恰好反应,为NaN3溶液,NaN3溶液中N3﹣水解,溶液呈碱性,故溶液中离子浓度顺序为c(Na+)>c(N3﹣)>c(OH﹣)>c(H+),故答案为:HN3+NaOH═NaN3+H2O;c(Na+)>c(N3﹣)>c(OH﹣)>c(H+);(5)镁、铝和稀硫酸反应生成硫酸镁、硫酸铝和氢气,硫酸镁、硫酸铝和氢氧化钠溶液反应生成氢氧化镁、氢氧化铝,氢氧化铝和氢氧化钠反应生成偏铝酸钠,氢氧化镁和氢氧化钠溶液不反应,灼烧氢氧化镁固体,氢氧化镁分解生成氧化镁和水,所以最后所得固体是氧化镁.a.根据n的量计算镁的质量,根据m、n计算铝质量,从而计算铝的质量分数,故正确;b.根据镁、铝的质量及镁铝和稀硫酸反应生成氢气的量计算铝和镁质量,从而计算铝的质量分数,故正确;c.根据n的质量计算镁的质量,根据镁的量计算镁和稀硫酸反应生成氢气的量,从而得出铝和稀硫酸反应生成氢气的量,故而得出铝的质量分数,故正确,故选:abc.
四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,Z最高正价与最低负价之和为零,则Z为Si元素,据此解答.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 下表是25℃时HClO2 及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | HCN | H2S |
Ka | 1×10﹣2 | 6.3×10﹣4 | 4.9×10﹣10 | K1=9.1×10﹣8K2=1.1×10﹣12 |
(1)常温下,物质的量浓度相等的①NaClO2、②NaF、③NaCN、④Na2S四种溶液的pH由大到小的顺序为;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”).
(2)Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1)此时的S2﹣的浓度为 .
已知Ksp(FeS)=6.3×10﹣18(molL﹣1)2 , Ksp(CuS)=6×10﹣36(molL﹣1)2 , Ksp(PbS)=2.4×10﹣28(molL﹣1)2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水份、空气中的氧气以及光照、受热而引起的.已知:
氧化性:IO ![]() >Fe3+>I2;还原性:S2O
>Fe3+>I2;还原性:S2O ![]() >I﹣
>I﹣
3I2+6OH﹣═5I﹣+IO ![]() +3H2O KI+I2=KI3
+3H2O KI+I2=KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是(用化学式表示);CCl4中显紫红色的物质是(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境中KI与氧气反应的化学方程式: . 将I2溶于KI溶液,在低温条件下,可制得KI3H2O.该物质作为食盐加碘剂是否合适?(填“是”或“否”),并说明理由: .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3
B.AlCl3
C.Na2CO3
D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质。下列判断正确的是
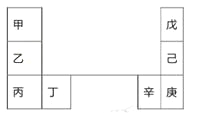
A. 金属性:甲>乙>丁
B. 原子半径:辛>己>戊
C. 丙和庚的原子核外电子数相差11
D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用标准的0.2mol/L的盐酸滴定待测的NaOH溶液,其实验操作如下:A.用碱式滴定管取待测液NaOH溶液放入锥形瓶,滴加2﹣3滴酚酞指示剂.
B.用待测的NaOH溶液润洗碱式滴定管.
C.检查滴定管是否漏水.
D.取下酸式滴定管,用标准的盐酸溶液润洗后,再将标准的盐酸注入酸式滴定管至刻度“0”以上2cm﹣3cm处,把酸式滴定管固定好,调节液面.
E.把滴定管用蒸镏水洗净,并分别固定在滴定管架两边.
F.另取锥形瓶,再重复滴定操作一次.
G.把锥形瓶放在酸式滴定管的下面,瓶下垫一张白纸,然后边滴定边摇动锥形瓶,直至终点,记下滴定管的液面所在刻度.
据上述滴定操作,完成下列填空:
(1)滴定操作的正确操作顺序是(用上述各编号字母填写)→E→→B→→→;
(2)G步操作中判断滴定终点的依据是;
(3)D步骤的操作中液面应调节到 , 尖嘴部分应;
(4)酸式滴定管未用标准的盐酸润洗,待测溶液NaOH的测定值会;碱式滴定管未用待测的NaOH溶液润洗,待测NaOH溶液的测定值会 . (填“偏高”、“偏低”或“无影响”.)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为C2H6+18OH﹣﹣14e﹣═2CO ![]() +12H2O.有关此电池的推断不正确的是( )
+12H2O.有关此电池的推断不正确的是( )
A.通入氧气的电极为正极
B.参加反应的O2与C2H6的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.放电一段时间后,正极区附近溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是
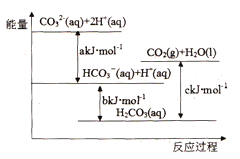
A. H2CO3(aq)=CO2(g)+H2O(l)为放热反应
B. CO32-(aq)+ H+(aq)=HCO3-(aq) △H=akJ/mol
C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) △H=(c-b)kJ/mol
D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) △H=(a+b-c)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com