
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g?L-1 |
| 排放标准 | pH 6~9 | 0.5mg?L-1 |
| ||
| 1L |
| Ksp(FeAsO4) |
| c(Fe3+) |
| c(AsO43-)?c(H+) |
| c(HAsO42-) |
| c(HAsO42-)?c(OH-) |
| c(AsO43-) |
| c(HAsO42-)?c(OH-)?c(H+) |
| c(AsO43-)?c(H+) |
| Kw |
| K3 |
| 10-14 |
| 4.0×10-12 |


科目:高中化学 来源: 题型:
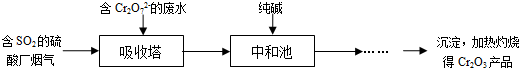
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省潮州市高三第二次高考模拟考试理综化学试卷(解析版) 题型:填空题
某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:

相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
|
难溶物 |
Ksp |
|
Ca3(AsO4)2 |
6.8×10-19 |
|
CaSO4 |
9.1×10-6 |
|
FeAsO4 |
5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
|
污染物 |
H2SO4 |
As |
|
废水浓度 |
29.4g/L |
1.6g·L-1 |
|
排放标准 |
pH 6~9 |
0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=
。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O HAsO42-+OH-,该步水解的平衡常数(25℃)为:
(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为:
(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com