
已知33As、35Br位于同一周期。某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是___ _____。
_____。
(3)在该反应条件下可推知________(填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为________,其中1 mol KBrO3得到电子的物质的量为________mol。
解析 (1)KBrO3在反应中得到电子,化合价降低,KBrO3为氧化剂,则X为对应的还原产物。比较余下物质中各元素化合价的变化,可知AsH3在反应中失去电子,为还原剂,被氧化生成H3AsO4。(2)设X中Br元素的化合价为x,则有:0.2 mol×(5-x)=1 mol,解得x=0,故X为Br2。(3)写出化学反应方程式:AsH3+KBrO3+H2SO4―→H3AsO4+Br2+K2SO4+H2O,由氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性可知,氧化性:KBrO3>H3AsO4,还原性:AsH3>Br2。(4)配平反应方程式可得:5AsH3+8KBrO3+4H2SO4===5H3AsO4+4Br2+4K2SO4+4H2O,氧化剂(KBrO3)与还原剂(AsH3)的化学计量数分别为8和5,根据化合价变化可知1 mol KBrO3得到电子的物质的量为5 mol。
答案 (1)AsH3 (2)Br2 (3)ac (4)8∶5 5


科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的数值。下列有关叙述正确的是 ( )。
A.标准状况下,2.24 L庚烷含有的分子数等于0.1 NA
B.常温下,100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数为0.1 NA
C.分子数为NA的CO、C2H4的混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N—H键数目为0.6  NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述I和叙述II均正确且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4可以发生 |
| C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
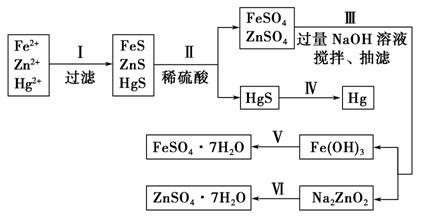
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】 NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为_________________________________。
(2)步骤Ⅲ中抽滤的目的是____________,该步骤产生Fe(OH)3的反应的离子方程式为_________________ _____________________________________。
_____________________________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为___________________________ _____________________________________________________________。
(4)欲实现步骤Ⅴ,需加入的试剂有________、________,所涉及的主要操作依次为__________________________________________________________。
(5)步骤Ⅳ常用的方法是________,该步骤是否对环境有影响?________(填“是”或“否 ”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应:_____________________________________________________________。
”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应:_____________________________________________________________。
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列叙述不正确的是 ( )。
A.氧化产物为Cl2
B.参加反应的氧化剂与还原剂的物质的量之比为1∶2
C.若有3 mol H2O生成,则反应中有2 mol电子转移
D.当该反应生成2.24 L Cl2(标准状况)时,反应中有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排列顺序不正确的是( )
A.热稳定性:CH4>SiH4>HF B.原子半径:Na>Mg>O
C.酸性:HClO4>H2SO4>H3PO4 D.非金属性:F>Cl>Br
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是( )。
A.Y的阴离子Y 2-的还原性强于X的阴离子X-
B.X的含氧酸的酸性比Y的含氧酸的酸性强
C.X的单质X2能将Y的阴离子Y 2-氧化,并发生置换反应
D.X的氢化物比Y的氢化物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ:某课外活动小组用如图装置进行实验,试回答下列问题。(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为
Ⅱ:下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(3)B中若收集到224ml气体(标准状况),则溶解的金属质量为
(4)C中被腐蚀的金属是__________(填化学式),A、B、C中铁被腐蚀的速率,
 由快到慢的是顺序是_____________(用“>”表示)。
由快到慢的是顺序是_____________(用“>”表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com