
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
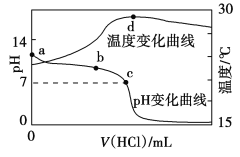
A. c点:c(Cl-)=c(NH4+)
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C. a点由水电离出的c(H+)=1.0×10-14mol·L-1
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
【答案】A
【解析】
A. c点:根据溶液电荷守恒c(Cl-) +c(OH-)=c(NH4+)+ c(H+);PH=7,c(OH-)=c(H+),得c(Cl-)=c(NH4+),故A正确;
B. 当氨水与盐酸恰好完全反应生成氯化铵时根据物料守恒得c(NH4+)+c(NH3·H2O)=c(Cl-),氯化铵属于强酸弱碱盐,水解会显酸性,而b点PH>7,显碱性,故B错误;
C. a点为1.000 mol·L-1氨水,溶液中氢离子由水提供,氢氧根离子主要由碱提供,所以根据图像可知,由水电离出的c(H+)>1.0×10-14mol·L-1,故C错误;
D. d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
正确答案:A。


科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Al、Mg合金加入到足量的40mL某浓度的盐酸中,充分反应后得到标准状况下的氢气896mL;若将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气672mL。
(1)当合金与盐酸反应时,转移电子总物质的量为_____mol;
(2)合金中Mg的质量为_____g;
(3)合金的平均摩尔质量为_____;
(4)若向与盐酸反应后的溶液中缓慢加入100mL 1mol/L 的NaOH溶液,沉淀质量恰好达到的最大值,则加入盐酸的浓度为_____mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质Y中逐渐加入(或通入)X溶液,生成沉淀的量与加入X的物质的量关系如图所示,下表中符合图示情况的是
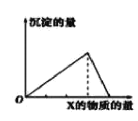
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:

①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
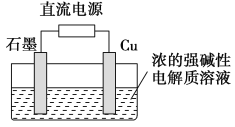
A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图表来处理数据是发现科学规律的一种重要方法。
(1)下图是原子序数为1~18的元素原子的最外层电子数随原子序数变化的直方图。图中元素a 是__,b 是____。

(2)下图表示元素的一种性质随原子序数变化的情况,根据分析,该图纵坐标表示的是_________。

(3)下表给出了部分元素的原子半径。
元素符号 | Li | Be | B | C | N | O | F | Na | K | Rb | Cs |
原子半径/nm | 0.152 | 0.089 | 0.082 | 0.077 | 0.075 | 0.074 | 0.071 | 0.186 | 0.227 | 0.248 | 0.265 |
请根据表中数据分析同周期元素原子半径的递变规律是______,同主族元素原子半径的递变规律是_____根据表中得出的规律比较Ca2+和Cl-的半径大小:r(Ca2+)_____r(Cl-)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液中加的溶质可能是( )
A.BaCl2、H2SO4、KClB.CaCl2、HNO3、AgNO3
C.CaCl2、HNO3、NaClD.BaCl2、HCl、Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦成功提取到一种分子式为C15H22O5的无色结晶体,命名为青蒿素,这是一种可用于治疗疟疾的固态有机药物,在水溶液中不电离,关于青蒿素的说法正确的是( )
A.5.64g青蒿素含氧原子数目为0.02NA
B.标准状况下2mol青蒿素的体积为44.8L
C.青蒿素属于非电解质
D.青蒿素的摩尔质量为282
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com