
【题目】用图表来处理数据是发现科学规律的一种重要方法。
(1)下图是原子序数为1~18的元素原子的最外层电子数随原子序数变化的直方图。图中元素a 是__,b 是____。

(2)下图表示元素的一种性质随原子序数变化的情况,根据分析,该图纵坐标表示的是_________。

(3)下表给出了部分元素的原子半径。
元素符号 | Li | Be | B | C | N | O | F | Na | K | Rb | Cs |
原子半径/nm | 0.152 | 0.089 | 0.082 | 0.077 | 0.075 | 0.074 | 0.071 | 0.186 | 0.227 | 0.248 | 0.265 |
请根据表中数据分析同周期元素原子半径的递变规律是______,同主族元素原子半径的递变规律是_____根据表中得出的规律比较Ca2+和Cl-的半径大小:r(Ca2+)_____r(Cl-)(填“>”“<”或“=”)。
【答案】Be Ar 元素的最高化合价和最低化合价 随着核电荷数的增多,原子半径逐渐减小 随着原子核外电子层数的增加,原子半径逐渐增大 <
【解析】
(1)根据图示,横坐标表示原子序数,纵坐标表示最外层电子数,由原子序数判断;
(2)根据图示,横坐标表示原子序数,纵坐标有正有负,并随原子序数呈周期性变化分析;
(3)结合表格中半径大小的数据分析判断同周期和同主族元素的半径变化规律;核外电子层结构相同的微粒,核电荷数越大,半径越小。
(1)根据图示,横坐标表示原子序数,纵坐标表示最外层电子数,由原子序数可知a为4号元素,则A为Be;b为18号元素,b为Ar;
(2)根据图示,横坐标表示原子序数,纵坐标有正有负,并随原子序数呈周期性变化,则该图纵坐标表示的是元素的最高化合价和最低化合价;
(3)根据表中数据分析,Li、Be、B、C、N、O、F为第二周期元素且原子核电荷数依次增大,根据表格数据,半径依次减小,则同周期元素原子半径的递变规律是随着核电荷数的增多,原子半径逐渐减小;Li、Na、K、Rb、Cs为第IA族元素,从上至下,核电荷数依次增大,根据表格数据,半径依次增大,则同主族元素原子半径的递变规律是随着原子核外电子层数的增加,原子半径逐渐增大;Ca2+和Cl-的核外电子层结构相同的微粒,核电荷数越大,半径越小,Ca核电荷数大于Cl,则r(Ca2+)<r(Cl-)。


科目:高中化学 来源: 题型:
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用如图装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。

操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中所进行反应的离子方程式为_____
(2)图中饱和食盐水的作用是_____
(3)图中盛NaOH溶液的瓶中反应的离子方程式为_____
(4)若用如图装置收集多余的氯气,请在虚线框内画出该装置简图_____

(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。(已知:Na2SO3溶液显碱性,Na2SO4溶液显中性)
提出猜想:
Ⅰ.NaClO把Na2SO3氧化成Na2SO4
Ⅱ.NaClO把酚酞氧化了
Ⅲ.NaClO把Na2SO3和酚酞都氧化了
①下列实验方案中,要证明NaClO氧化了Na2SO3的最佳实验方案是_____
a.向混合后的溶液中加入过量氯化钡溶液
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入氯化钡溶液
d.向混合后的溶液中加入氢氧化钡溶液,过滤后,在沉淀中加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
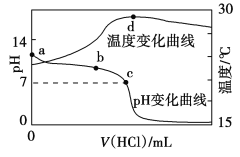
A. c点:c(Cl-)=c(NH4+)
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C. a点由水电离出的c(H+)=1.0×10-14mol·L-1
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
(1)写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(2)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______________________。
(3)欲用2LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp (BaCO3)=1×10-10]。(忽略溶液体积的变化)
(二)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。
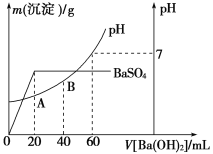
计算:(1)原混合溶液中c(Cl-)=________。
(2)A点的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见下图,下列说法错误的是

A. 上图所涉及到的化学反应都是氧化还原反应
B. N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键
C. NaNO2与N2H4生成NaN3的反应方程式为:NaNO2 + N2H4 = NaN3 + 2H2O
D. 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷催化裂化时碳链按两种方式断裂,生成两种烷烃和两种烯烃。如果丁烷的裂化率为60%,且裂化生成的两种烯烃物质的量相等,则裂化后得到的含氢质量分数最高的气体占混合气体的体积分数为
A. 18.75% B. 30% C. 15% D. 22.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,W、Z核外电子数之和是X核外电子数的2倍,Y的最外层电子数是其质子数的![]() 。下列叙述正确的是
。下列叙述正确的是
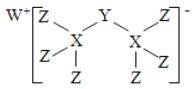
A. X、Z两元素可形成离子化合物
B. 气态氢化物的稳定性:X>Y>Z
C. 该新化合物中的Y元素满足8电子稳定结构
D. Y、Z元素分别对应的最高价氧化物的水化物均是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Cu(IO3)2+24KI+12H2SO4=2CuI![]() (碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
(碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
A.Cu(IO3)2作氧化剂,Cu(IO3)2中只有碘元素被还原
B.CuI既是氧化产物又是还原产物
C.每生成1mol CuI,有11mol KI发生氧化反应
D.每转移1.1mol电子,有0.2mol IO3-被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com